Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Напишите уравнение реакции гидролиза ангидрида пропионовой кислоты
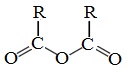
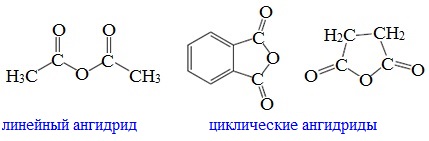
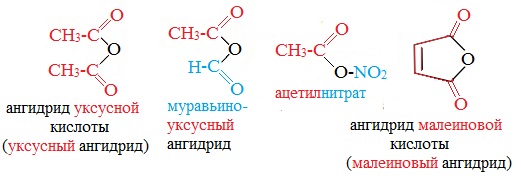
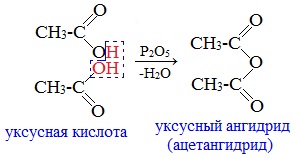
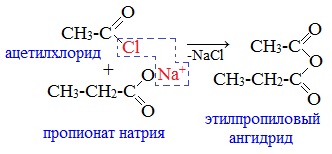
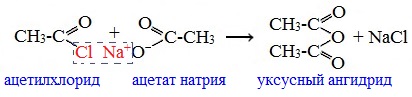
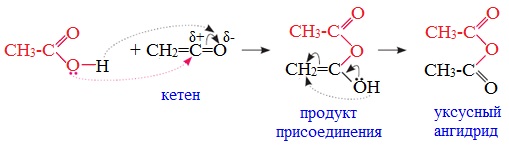
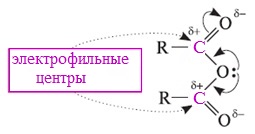
Классификация. НоменклатураАнгидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот: Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами. Названия ангидридов образуют из тривиальных названий соответствующих кислот: Способы получения1. Дегидратация карбоновых кислот Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3). 2. Взаимодействием галогенангидридов с солями карбоновых кислот Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот: 3. Взаимодействие карбоновых кислот с кетенами Ангидриды получают при взаимодействии карбоновых кислот с кетенами: Данный метод используется в промышленности для получения уксусного ангидрида. Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен. Физические свойстваАнгидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют. Характеристика реакционной способностиАнгидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами . Связи в молекулах ангидридов карбоновых кислот сильно поляризованы. Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы: Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп. Химические свойства1. Взаимодействие с водой (гидролиз) При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот: 2. Взаимодействие с аммиаком (аммонолиз) При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
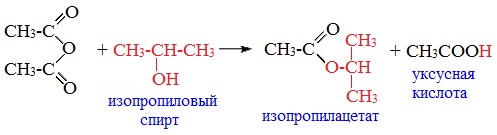
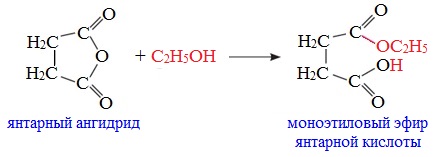
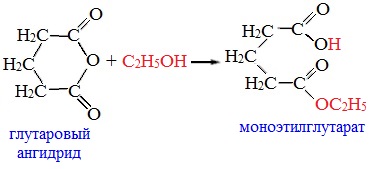
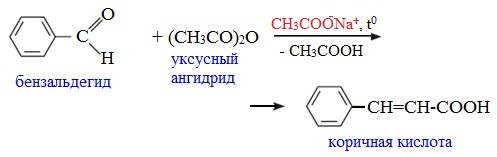
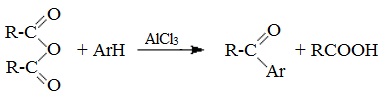
3. Взаимодействие со спиртами (алкоголиз) При обработке линейных ангидридов спиртами образуются сложные эфиры: Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот: 4. Реакции α-водородного атома Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты. 5. Образование ароматических кетонов При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса): Отдельные представители
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей. Напишите уравнения реакций: 1) Пропионовой кислоты с гидроксидом натрия. 2) Гидролиза пропилового эфира уксусной кислотыУкажите их тип, условия осуществления и назовите исходные в-ва и продукты реакций. 1) С2H5COOH + NaOH —> C2H5COONa + H2O — реакция нейтрализации (обмена) , нормальные условия, соль- пропионат натрия + вода источники: http://himija-online.ru/organicheskaya-ximiya/angidridy-karbonovyx-kislot.html http://sprashivalka.com/tqa/q/26850316 |

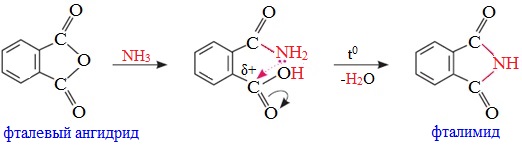
 Циклические ангидриды получают отщеплением воды от дикарбоновых кислот при их нагревании:
Циклические ангидриды получают отщеплением воды от дикарбоновых кислот при их нагревании:
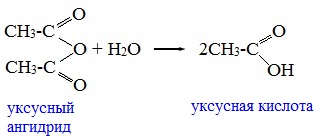
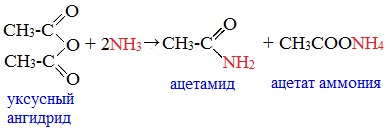
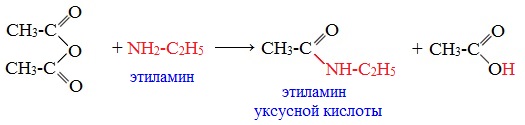
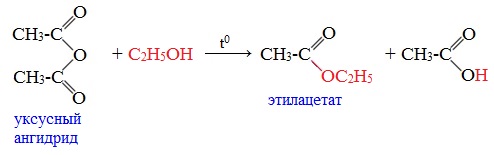
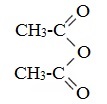 Уксусный ангидрид (CH3CO)2O — бесцветная жидкость с резким запахом (т.кип.140 0 С), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. С водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
Уксусный ангидрид (CH3CO)2O — бесцветная жидкость с резким запахом (т.кип.140 0 С), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. С водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
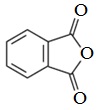 Фталевый ангидрид — белое кристаллическое вещество (т.пл.130,8 0 С), легко возгоняется, растворим в этаноле. Обладает свойствами ароматических соединений. Легко реагирует с фенолами и их производными.
Фталевый ангидрид — белое кристаллическое вещество (т.пл.130,8 0 С), легко возгоняется, растворим в этаноле. Обладает свойствами ароматических соединений. Легко реагирует с фенолами и их производными.