Напишите уравнение реакции гидролиза ацетилхолина
Для лечения двигательных нарушений после травм, параличей, полиомелита используют препарат калимин, который по структуре похож на ацетилхолин. Как изменится концентрация ацетилхолина в нервно-мышечных синапсах после поступления нервного импульса при лечении калимином? Для ответа на вопрос:
а) Опишите влияние структурных аналогов субстратов на активность ферментов
б) Напишите реакцию гидролиза ацетилхолина и объясните ее значение для проведения нервного импульса.
После поступления нервного импульса при лечении калимином концентрация ацетилхолина увеличится.
а) Использование структурных аналогов является конкурентным ингибированием. В результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. С ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплекс фермент-субстрат ( ES ) или фермент-ингибитор ( EI ). При формировании комплекса фермента и ингибитора ( EI ) продукт реакции не образуется.
Калимин является структурным аналогом ацетилхолина и ингибирует ацетилхолинэстеразу (АХЭ), катализирующую реакцию гидролиза ацетилхолина.
При добавлении ингибиторов активность ацетилхолина увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы использую при лечении мышечных дистрофий.
Холин и уксусная кислота не способны действовать как нейромедиаторы.
Напишите уравнение реакции гидролиза ацетилхолина
Ацетилхолин (АХ) — очень важный медиатор. Деятельность холинергических нейронов центральной нервной системы (ЦНС), направляющихся от базальных структур переднего мозга к гиппокампу, обеспечивает возможность обучения и запоминания. Повреждение этих нейронов приводит к возникновению болезни Альцгеймера.
В периферической нервной системе холинергическими являются все двигательные нейроны скелетной мускулатуры, преганглионарные нейроны, иннервирующие симпатические и парасимпатические ганглии, а также постганглионарные нервные волокна, осуществляющие парасимпатическую иннервацию сердечной мышцы, гладкой мускулатуры кишечника и мочевого пузыря, а также гладкой мускулатуры глаза, ответственной за процессы аккомодации и зрения на близком расстоянии.
Ацетилхолин (АХ) синтезируется при переносе ацетильной группы с ацетилокофермента А (ацетил-КоА) на холин под действием фермента холинацетилтрансферазы. Холинацетилтрансфераза присутствует исключительно в холинергических нейронах. Холин поступает в нейрон из межклеточного пространства путем активного транспорта. Ацетил-КоА синтезируется в митохондриях, которые синтезируют холинацетилтрансферазу и в большом количестве расположены в нервных окончаниях.
После высвобождения ацетилхолина (АХ) в синаптическую щель происходит его разрушение под действием ацетилхолинестеразы (АХЭ) с образованием холина и уксусной кислоты, которые подвергаются обратному захвату и повторному использованию для синтеза новых молекул медиатора.
Этапы синтеза, распада и обратного захвата ацетилхолина (АХ) представлены на рисунке ниже.
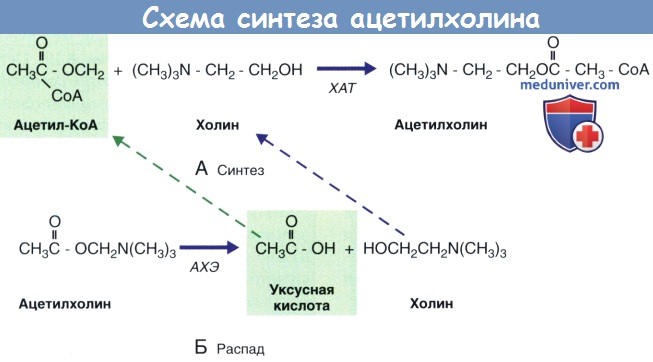
(Б) Распад молекулы ацетилхолина под действием ацетилхолинэстеразы (АХЭ).
Пунктирными стрелками обозначено повторное использование уксусной кислоты и холина.
Выделяют медиаторозависимые рецепторы ацетилхолина (АХ) и рецепторы, связанные с G-белками. Ионотропные рецепторы ацетилхолина (АХ) называют никотиновыми, поскольку первым веществом, которое вызвало их активацию, был никотин, выделенный из растения табака. Метаботропные рецепторы АХ называют мускариновыми, так как их активатором служит мускарин — вещество, выделенное из ядовитых грибов мухоморов.
1. Никотиновые рецепторы. Никотиновые рецепторы сосредоточены в нервно-мышечных синапсах скелетной мускулатуры, во всех вегетативных нервных ганглиях, а также в ЦНС. При воздействии АХ происходят открытие ионного канала и быстрое поступление ионов Са 2+ и Na + в клетку, что приводит к деполяризации нейрона-мишени.
Никотиновые рецепторы рассмотрены подробнее при описании процесса иннервации скелетной мускулатуры в отдельной статье на сайте.
2. Мускариновые рецепторы. G-белок-зависимые мускариновые рецепторы сконцентрированы (а) в височной доле головного мозга, где они участвуют в процессе формирования памяти; (б) в вегетативных ганглиях; (в) в волокнах сердечной мышцы, включая проводящие волокна; (г) в гладкой мускулатуре кишечника и мочевого пузыря; (д) в секреторных клетках потовых желез.
Выделяют пять подтипов мускариновых рецепторов — М1-М5 M1, M3— и М5-рецепторы — возбуждающие: посредством ферментных каскадов происходят активация фосфолипазы С и повышение внутриклеточного уровня Са 2+ . М2— и М4-рецепторы представляют собой тормозные ауторецепторы, уменьшающие внутриклеточный уровень цАМФ и/или увеличивающие выход К + из клетки в ходе гиперполяризации.
Холинергические процессы в сердце и других внутренних органах описаны в отдельной статье на сайте.
3. Обратный захват ацетилхолина. Продукты гидролиза ацетилхолина в синаптической щели — холин и ацетил-группа — захватываются молекулами специфических переносчиков обратно в клетку.
4. Отравление стрихнином. Стрихнин блокирует рецепторы глицина. Мучительные судороги при отравлении стрихнином обусловлены растормаживанием α-мотонейронов, вызванным нарушением тормозных влияний клеток Реншоу. Клинические проявления напоминают таковые при отравлении столбнячным токсином, который, как известно, препятствует высвобождению глицина из клеток Реншоу.
В ходе патологоанатомических исследований неизмененного мозга с использованием меченых молекул стрихнина было показано, что рецепторы глицина в большом количестве представлены на ассоциативных нейронах ядра тройничного нерва, иннервирующего жевательные мышцы, а также ядра лицевого нерва, иннервирующего мимическую мускулатуру. Именно эти две группы мышц в большей степени подвержены судорогам при отравлении.
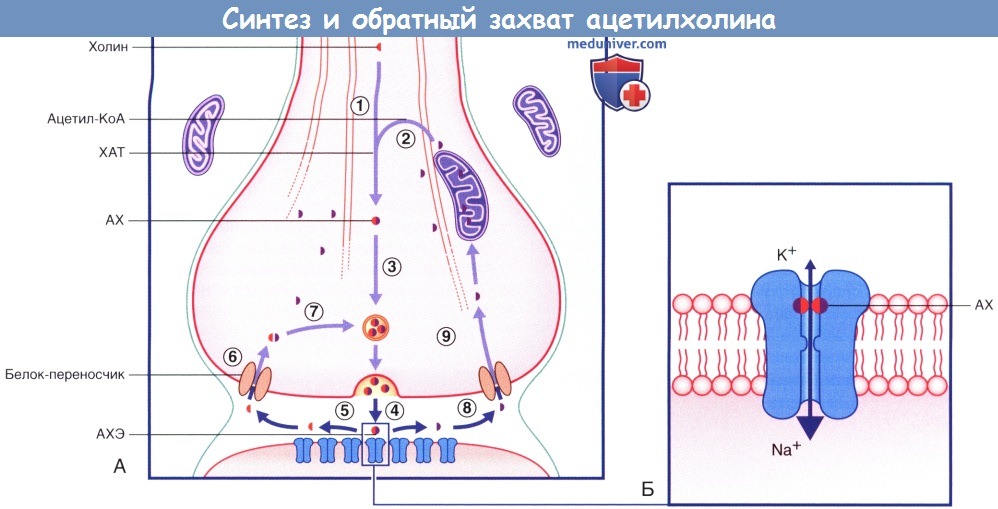
(1) Молекулы холина захватываются из межклеточной жидкости и передаются в нервное окончание.
(2) Под действием митохондриального фермента холинацетилтрансферазы (ХАТ) происходит ацетилирование холина ацетилкоферментом А (ацетил-КоА) с образованием ацетилхолина (АХ).
(3) Молекулы АХ помещаются в синаптические пузырьки.
(4) АХ высвобождается и связывается с соответствующими рецепторами.
(5) Под действием ацетилхолинэстеразы (АХЭ) происходит гидролиз молекул медиатора.
(6) Холиновые фрагменты молекул транспортируются обратно в цитозоль.
(7) Под действием трансфераз происходит синтез новых молекул ацетилхолина, которые вновь помещаются в синаптические пузырьки.
(8) Ацетатный фрагмент молекулы перемещается в цитозоль.
(9) В митохондриях происходит синтез новых молекул ацетил-КоА из уксусной кислоты.
(Б) Медиаторозависимый никотиновый рецептор. Присоединение АХ вызывает поступление большого количества ионов Na + в клетку и выход небольшого количества ионов К + из клетки.
Редактор: Искандер Милевски. Дата публикации: 12.11.2018
Кинетика и термодинамика ферментативных реакций (стр. 9 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Задача 3.3. Аспартат-карбамоилтрансфераза катализирует следующую реакцию:
Аспартат + карбамоилфосфат → карбамоиласпартат + ортофосфат
и является первым ферментом при синтезе СТР. Активность фермента определяли по освобождению неорганического фосфата через определенные промежутки времени. Данные опытов, в которых определялась начальная скорость реакции при различных концентрациях аспартата, фиксированной концентрации карбамоилфосфата (3 мМ) и фиксированной концентрации СТР (0,1 мМ) приведены в табл. 3.3.
Определить кинетические параметры нативного и прогретого фермента: коэффициент Хилла, коэффициент крутизны, Vmax, [S]0,5.
Задача 3.4. Аспартат-карбамоилтрансфераза катализирует следующую реакцию:
Аспартат + карбамоилфосфат → карбамоиласпартат + ортофосфат
и является первым ферментом при синтезе СТР. Активность фермента определяли по освобождению неорганического фосфата через определенные промежутки времени. Данные опытов, в которых определялась начальная скорость реакции при различных концентрациях аспартата, фиксированной концентрации карбамоилфосфата (3 мМ) и фиксированной концентрации АТР (2мМ) приведены в табл. 3.4.
Определить кинетические параметры нативного фермента и фермента в присутствии АТР: коэффициент Хилла, коэффициент крутизны, Vmax, [S]0,5.
Задача 3.5. Исследовалось влияние малеата на активность аллостерического фермента аспартат-карбамоилтрансферазы. В эксперименте использовался как нативный, так и прогретый фермент. Результаты, полученные в присутствии фиксированных концентраций аспартата и карьамоилфосфата (1 мМ и 3 мМ соответственно) и варьируемых концентраций малеата, приведены в табл. 3.5а.
Механизм ингибирования прогретого фермента изучали, изменяя концентрацию аспартата при двух фиксированных концентрациях малеата. Использовали различные концентрации фермента. Полученные результаты приведены в табл. 3.5б.
Скорость реакции, мкмоль фосфата/ч
Какие выводы о регуляции активности фермента можно сделать на основании полученных данных?
Задача 3.6. Исследована кинетика действия глюкозо-6-фосфатдегидрогеназы из азотфиксирующих бактерий Azotobacter beijerinckii.
Глюкозо-5-фосфат + NADP+ ↔ 6-фосфоглюконат + NADPH + H+
Изучено влияние АТР на активность фермента. Получены приведенные ниже данные о зависимости начальной скорости реакции от концентрации глюкозо-6-фосфата в отсутствие и в присутствии АТР (при трех различных концентрациях); во всех опытах количество фермента (по белку) 0,75 мкг (табл. 3.6).
Начальная скорость восстановления NADP+, нмоль/мин
концентрация АТР, мМ
По данным табл. 3.6 построить график в координатах v ; [S] и определить по нему Vmax. Для рассматриваемой системы Vmax = 29,5 нмоль/мин. Для определения коэффициента h (коэффициента взаимодействия, коэффициента Хилла) необходимо построить график Хилла.
Задача 3.7. Исследовалась кинетика глюкозо-6-фосфатдегидрогеназы в гемолизатах клеток красной крови кроликов.
Раздел 4. Задачи к коллоквиумам и тестам
Задача 4.1. Фермент проявляет относительную специфичность. Определите, исходя из величины Км тот субстрат, который будет подвеграться каталитическому превращению с наибольшей скоростью при концентрации субстрат а, равной : а) Км= 2*10-1М; б) Км= 2*10-3М;в) Км= 2*10-4М; г) Км= 2*10-6М.
Задача 4.2. При изучении кинетики гидролиза ацетилхолина, катализируемого ацетилхолинэстеразой, было показано, что ферментативная реакция ингибируется субстратом с константой диссоциации неактивного тройного комплекса ЕS2, равной 3,2 10-2 М. Найти значение концентрации субстрата, при которой скорость ферментативной реакции достигает максимального значения в условиях эксперимента, если величина константы Михаэлиса, найденная при использовании низких концентраций субстрата, равна 2,6 х·10-4 М.
Задача 4.3. Фермент имеет константу Михаэлиса, равную 0,035 М. Скорость реакции при концентрации субстрата, равной 0,110 моль/л, равна 1,15*10-3 моль/(л*с). Найдите максимальную скорость этой реакции.
Задача 4.4. Ферментативная реакция (Км = 2,7*10-3 М) подавляется конкурентным игибитором (КI = 3,1*10-5 М). Концентрация субстрата равна 3,6*10-4 моль/л. Сколько ингибитора потребуется для подавления реакции на 65%? Во сколько раз надо повысить концентрацию субстрата, чтобы уменьшить степень ингибирования до 25%?
Задача 4.5. Проанализируйте уравнение Михаэлиса-Ментен и ответьте на следующие вопросы:
а) При какой концентрации субстрата фермент, для которого максимальная скорость превращения субстрата составляет 30 мкмолей/мин мг, а величина КМ равна 0,005 М, будет работать со скоростью, равной 1/4 максимальной? б) Определите, какую долю VMAX, будет составлять скорость реакции при концентрациях субстрата, равных 1/2 КМ, 2КМ и 10Км.
Задача 4.6. Вирус иммунодефицита кодирует протеазу, которая необходима для внедрения и созревания вируса. Протеаза катализирует гидролиз субстрата (пентапептид) с начальной скоростью 0,0035 моль/с. Концентрация пентапептида равна 0,045 М. Константа Михаэлиса фермента для данного субстрата равна 0,075 М. Производное пентапептида, в котором пептидная связь замещена на –СН2NH, не гидролизуется протеазой и является ингибитором. В присутствии 2,5 мкМ ингибитора максимальная скорость равнялась 0,0093 моль/с, а начальная скорость составила 0,0030 моль/с. Определите тип ингибирования.
Задача 4.7. Вирус иммунодефицита кодирует протеазу, которая необходима для внедрения и созревания вируса. Протеаза катализирует гидролиз субстрата (пентапептид) с начальной скоростью 0,0035 моль/с. Концентрация пентапептида равна 0,045 М. Константа Михаэлиса фермента для данного субстрата равна 0,075 М. Определите VMAX фермента для пентапептида.
Задача 4.8. Гидролиз п-нитрофенилфосфата фосфатазой можно определить, измеряя скорость образования продукта п-нитрофенола. Используя стандартные условия (рН 7,0 и 250С) с суммарным объемом инкубационной среды, равной 5 мл, которая содержала 1 мкмоль фосфатазы, были определены Км и Vmax. Они были равны, соответственно, 2,0 мМ и 5 мМ/мин. Определите величину скорости реакции, когда 10 мкмоль п-нитрофенилфосфата присутствуют в инкубационной пробе. Сходный субстрат, о-нитрофенилфосфат имеет Км, равную 4 мМ при стандартных условиях. К какому из субстратов, п-нитрофенилфосфату или о-нитрофенилфосфату фермент имеет большее сродство?
Задача 4.9. Каталитическое расщепление пептидной связи в маленьких пептидах под действием фермента эластазы показало следующие результаты:
http://meduniver.com/Medical/Neurology/acetilxolin.html
http://pandia.ru/text/78/388/22072-9.php

