Гидролиз сульфата меди (II)
CuSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Cu 2+ + 2SO4 2- + 2HOH ⇄ 2CuOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Cu 2+ + HOH ⇄ CuOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2CuOH + + SO4 2- + 2HOH ⇄ 2Cu(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
CuOH + + HOH ⇄ Cu(OH)2 + H +
Среда и pH раствора сульфата меди (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
При гидролизе какой соли образуется кислая среда в растворе : CuSO4, Na2CO3 или FeCl2?
Химия | 10 — 11 классы
При гидролизе какой соли образуется кислая среда в растворе : CuSO4, Na2CO3 или FeCl2?
Напишите уравнение реакции.
Гидролиз– это химическое взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменениемpH среды.
1. Na3PO4это соль сильного основания (щелочи) NaOH и средней кислоты (фосфорной) H3PO4.
Гидролиз соли идет по анионному типу, т.
К. катион Na + , связываясь с гидроксил — анионом OH¯, образует сильный электролит NaOH, который диссоциирует на ионы.
Фосфорная трехосновная кислота образует три вида солей :
NaH2PO4 –первичный фосфат Na, хорошо растворимый
Na2HPO4 – вторичный фосфат Na, практически нерастворимый
Na3PO4 — третичный фосфат Na, практически нерастворимый.
Из этого ясно, что при гидролизе Na3PO4, т.
Е. реакции, идущей до образования слабодиссоциирующей (плохорастворимой) соли, будет образовываться вторичный фосфат натрия Na2HPO4.
Ионно — молекулярное уравнение
PO4¯³ + H2O ↔ HPO4¯² + OH¯
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
Ионно — молекулярное уравнение
Na2HPO4 + H2O↔ H2PO4¯² + OH¯
Na2HPO4 + H2O↔ NaH2PO4 + NaOH
Ионно — молекулярное уравнение
H2PO4¯ + H2O = H3PO4 + OH¯
NaH2PO4 + H2O = H3PO4 + NaOH
Обычно реакция идет по первой ступени, далее накапливаются гидроксильные ионы OH¯ и не дают реакции идти до конца.
Так как образуется кислая соль и сильное основание (щелочь), реакция раствора будет щелочная, т.
2. СольK2S, сульфид калия– это соль сильного основания и слабой фтористоводородной кислоты H2S.
Гидролиз соли будет идти в две ступени, т.
К. сероводородная кислота двухосновна, по анионному типу.
СольK2S при растворении в воде диссоциирует на катион К + и сульфид — анион S¯².
Катион К + не может связать гидроксильный анион, т.
К. при этом образуется сильный электролит KOH, который тут же диссоциирует на ионы, а сульфид — анион S¯² слабой кислоты связывается с гидроксильной группой в малодиссоциирующее соединение.
Ионно — молекулярное уравнение
K2S + H2O = KHS + KOH
Ионно — молекулярное уравнение
HS¯ + H2O = H2S + OH¯
KHS + H2O = H2S + KOH
Гидролиз протекает по первой ступени с образованием сильнощелочной реакции, pH> ; 7.
3. CuSO4, сульфат меди– соль сильной кислоты и слабого многокислотного основания .
Гидролиз соли будет идти с образованием катионов основной соли CuOH + .
Ионно — молекулярное уравнение
Cu + ² + H2O↔ CuOH + + H +
CuSO4 + H2O ↔ (CuOH)2SO4 + H2SO4
По 2 ступени реакция не пойдет из — за образующегося избытка ионов водорода сильной серной кислоты.
Среда имеет кислую реакцию, pH< ; 7.
Какая среда в растворе соли Al(NO3)3?
Какая среда в растворе соли Al(NO3)3?
Составьте уравнение реакции гидролиза этой соли.
Напишите уравнения гидролиза и укажите реакцию среды растворов следующих солей : а) NH4NO3 ; б)Al(CH3COO)3 ; в)ZnCl2?
Напишите уравнения гидролиза и укажите реакцию среды растворов следующих солей : а) NH4NO3 ; б)Al(CH3COO)3 ; в)ZnCl2.
Напишите уравнение гидролиза соли сульфата цинка в молекулярной ионной и сокращенной ионной форме укажите реакцию в среды в растворе соли?
Напишите уравнение гидролиза соли сульфата цинка в молекулярной ионной и сокращенной ионной форме укажите реакцию в среды в растворе соли.
Напишите уравнение реакции гидролиза сульфата железа (?
Напишите уравнение реакции гидролиза сульфата железа (!
). Укажите среду раствора.
При гидролизе какой соли образуется щелочная среда в растворе : K2CO2 NH4NO2 или KNO2?
При гидролизе какой соли образуется щелочная среда в растворе : K2CO2 NH4NO2 или KNO2?
Напишите уравнение реакции.
Помогите с заданием?
Помогите с заданием.
Напишите уравнения реакций гидролиза.
Определите способность данной соли к гидролизу.
Какова будет реакция среды ( кислая или щелочная), цвет раствора индикатора?
При гидролизе соли NаNO3 среда растворащелочнаякислаянейтральная?
При гидролизе соли NаNO3 среда раствора
Напишите реакцию гидролиза солей и определите среду раствора Ag2S?
Напишите реакцию гидролиза солей и определите среду раствора Ag2S.
Какая среда в растворе соли Li2SO4?
Какая среда в растворе соли Li2SO4?
Составьте уравнение реакции гидролиза этой соли.
Гидролиз кислых солей Запуталась?
Гидролиз кислых солей Запуталась.
Как правильно написать?
В результате гидролиза гидросульфата калия образуется Н + , поэтому среда кислая.
А как правильно написать — гидролиз этой соли по катиону или аниону?
Если вам необходимо получить ответ на вопрос При гидролизе какой соли образуется кислая среда в растворе : CuSO4, Na2CO3 или FeCl2?, относящийся к уровню подготовки учащихся 10 — 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
«Гидролиз солей»
Рефераты по химии / Химический эксперимент по неорганической химии в системе проблемного обучения / Методические рекомендации и разработки содержания школьного химического эксперимента в системе проблемного обучения / «Гидролиз солей»
2CuSO4 + 2Na2CO3 + H2O = (СuOH)2CO3 + CO2 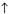
CuSO4 + Na2CO3 + H2O = Сu(OH)2 ↓+ CO2 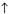
В реакции солей FeCl3 и Na2CO3 учащиеся наблюдают выпадение бурого осадка и выделение газа, не поддерживающего горение. Довольно быстро они делают вывод, что совместный гидролиз хлорида железа, гидролизующегося по катиону, и карбоната натрия, гидролизующегося по аниону, приводит к гидроксиду железа(III) и оксиду углерода(IV). Эти вещества являются продуктами последних ступеней гидролиза исходных солей:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2 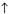
2Fe3+ + 3CO32– + 3H2O = 2Fe(OH)3↓ + 3CO2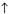
Занятие № 9. Амфотерные соединения
Приведённые ниже опыты проводились при объяснении нового материала в изучении темы «Амфотерные оксиды и гидроксиды» у учеников 9-х классов (см. тематическое планирование для 9 класса, урок 3). Использовался теоретический материал учебника 9 класса О. С. Габриеляна Химия-9 [10], методическое пособие для учителя [9], настольная книга для учителя [6], рабочая тетрадь [11].
используя проблемный эксперимент, дать понятие об амфотерности оксидов и гидроксидов металлов и особенностях их химических свойств.
Форма проведения эксперимента
фронтальная (демонстрационный эксперимент)
Оборудование и реактивы:
Проведение работы начинают с эвристической беседы.
Учитель: приведите классификацию простых веществ, оксидов, гидроксидов.
Ученик: простые вещества: металлы и неметаллы; оксиды: оксиды неметаллов (кислотные) и оксиды металлов (основные); гидроксиды: гидроксиды металлов и кислородсодержащие кислоты (гидроксиды неметаллов).
Учитель: предложите соответствующие друг другу химические формулы представителей простых веществ, оксидов и гидроксидов (для дальнейшего обсуждения учитель выбирает те соединения, которые необходимы ему для работы)
Ученик: простые вещества: металлы – Na, Ca, Zn, Fe, Al, Cr; неметаллы: S, O2, N2, Cl2; оксиды: основные – Na2О, CaО, ZnО, FeО, Fe2О3, Al2О3, Cr2О3, CrО; кислотые – SО3, SО2, N2О5, Cl2О7; гидроксиды: металлов – NaОН, Ca(ОН)2, Zn(ОН)2, Fe(ОН)2, Fe(ОН)3, Al(ОН)3, Cr(ОН)2, Cr(ОН)3 ; неметаллов – Н2SО4, Н2SО3, НNО3, НClО4, HCl.
Учитель: составьте возможные уравнения реакций между веществами: Ca, Zn, Al; CaО, ZnО, Al2О3; SО3; Ca(ОН)2, Zn(ОН)2, Al(ОН)3, Н2SО4
Ученик: Са + SО3→ ; Са + Н2SО4→ ; Zn + SО3→ ; Zn + Н2SО4→ ; Al + SО3→ ; Al + Н2SО4→ ; и т.д.
Учитель: учитель все предложенные вами реакции вписываются в правило, что вещества металлической природы реагируют с веществами неметаллической природы. Получим некоторые из этих гидроксидов и подтвердим это утверждение реакциями с мерной кислотой.
Опыт 1. Получение гидроксида кальция и опыты с ним
Учитель получает гидроксид кальция взаимодействием хлорид кальция, приливая по каплям гидроксид натрия, обращая внимание при этом, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
СaCl2 + 2NaOH → Ca(ОН)2 ↓+ 2NaCl;
Ca(ОН)2 ↓+ Н2SО4 → CaSО4 + 2Н2О;
Опыт 2. Получение гидроксида цинка и гидроксида алюминия и опыты с ними
Учитель получает гидроксид цинка взаимодействием хлорид цинка, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок, затем учитель целенаправленно приливает избыток щелочи.
Ученик: осадок растворился. Уравнение реакции получения гидроксида цинка:
ZnCl2 + 2NaOH → Zn(ОН)2 ↓+ 2NaCl;
Учитель: проведём реакцию получения гидроксида алюминия: учитель получает гидроксид алюминия взаимодействием хлорид алюминия, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок.
Ученик: предлагает приливать щёлочь осторожно, чтобы провести реакцию с серной кислотой, подтвердив их предположение. Составляет уравнение реакции получения гидроксида алюминия: AlCl3 + 3NaOH → Al(ОН)3 ↓+ 3NaCl
Информация о химии
Квантово-химические правила отбора элементарных стадий
Любая термодинамически разрешенная реакция, в которой происходит незначительное перемещение ядер (близость минимумов энергетических термов) и мало изменяются электронные состояния (принцип наименьшего движения), и молек .
Уилкинсон (Wilkinson), Джеффри
Джефри УилкинсонАнглийский химик Джефри Уилкинсон родился в Спрингсайде, неподалеку от Манчестера, в семье Генри Уилкинсона, специалиста по отделке домов и декоратора, и Рут Уилкинсон, происходившей из семьи фермеров и ткачей. У н .
Очистка антител для диагностики и изучения заболеваний
Исследователи из Китая заявляют, что полимер, функционализированный фрагментами бороновых кислот, позволяет дешево и быстро очистить антитела для изучения и диагностики заболеваний. Антитела, также известные как иммуноглобулины, .
http://himia.my-dict.ru/q/6444404_pri-gidrolize-kakoj-soli-obrazuetsa-kislaa/
http://www.chemicalnew.com/chemis-545-2.html






