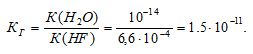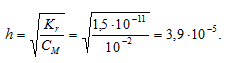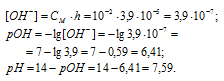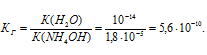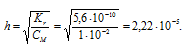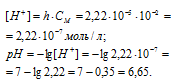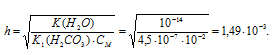Что такое гидролиз солей
| Гидролиз соли — взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита |
В общем случае под гидролизом понимают обменное разложение веществ водой, как органических, так и неорганических. Из неорганических веществ чаще всего гидролизу подвергаются соли.
Количественно гидролиз соли характеризуется степенью гидролиза, который зависит от природы самой соли, концентрации раствора, температуры:
| Степень гидролиза (h) равна отношению числа гидролизованных молекул (n) к общему числу растворенных молекул (N) h=n/N |
Схема реакции гидролиза:
- XY — соль;
- HOH — молекула воды;
- XH — кислота;
- HOY — основание.
Скорость гидролиза растет с:
- повышением температуры;
- увеличением разведения раствора.
Реакция гидролиза, как правило, обратимая, при этом равновесие реакции можно смещать в ту или другую сторону, добавляя к раствору соли сильную кислоту, либо сильное основание.
Всего возможны 4 варианта гидролиза солей, в зависимости от способа образования соли:
- гидролиз по катиону — соль образована сильной кислотой и слабым основанием: NH4NO3, NH4Cl; ZnCl2; [Cu(NO3)2]; AlCl3;
- гидролиз по аниону — соль образована слабой кислотой и сильным основанием: KNO2, Na2CO3; Na2SO3; K2S; CH3COONa;
- гидролиз по катиону и аниону — соль образована слабой кислотой и слабым основанием: NH4CN; Al2S3; NH4NO2; CH3COONH4;
- соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
- сильные кислоты: HNO3, H2SO4, HCl, HBr, HI, HClO4, H2CrO4;
- слабые кислоты: HNO2, HF, HCN, H2SO3, H2CO3, H2S, CH3COOH;
- сильные основания: LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, Sr(OH)2;
- слабые основания: NH4OH, Fe(OH)2, Fe(OH)3, Cr(OH)3, Cu(OH)2, Zn(OH)2, Al(OH)3.
| Сильные основания | Слабые основания | ||
|---|---|---|---|
| Сильные кислоты | гидролиза нет pH=7 | гидролиз по катиону pH 7 | гидролиз по катиону и аниону pH≈7 |
Гидролиз по катиону
- NH4NO3 — нитрат аммония образован сильной кислотой и слабым основанием;
- NH4OH — слабое основание;
- HNO3 — сильная кислота.
Уравнение гидролиза по катиону в ионном виде:
В процессе гидролиза катион NH4 + связывает гидроксид-ионы [OH — ] воды (красный цвет), в результате чего появляется избыток катионов водорода [H + ] и раствор становится кислым [H + ]>[OH — ] (pH K + + NO2 — + H OH ↔ HNO2 + K + + OH —
При гидролизе солей по аниону все происходит с точностью, до наоборот — анион слабой кислоты NO2 — связывает катион водорода [H + ] (выделены синим цветом), в результате чего появляется избыток гидроксид ионов [OH — ], раствор становится щелочным [H + ] — ] (pH>7).
Гидролиз по катиону и аниону
- NH4CN — цианид аммония образован слабой кислотой и слабым основанием;
- HCN — слабая кислота;
- NH4OH — слабое основание.
Уравнение гидролиза по аниону и катиону в ионном виде:
NH4 + + CN — + H OH ↔ NH4OH + HCN
Реакция раствора соли NH4CN слабощелочная, поскольку Kд(NH4OH)>Kд(HCN).
Кислотность раствора зависит от силы образующихся кислоты и основания. Гидролиз солей, образованных слабыми кислотами и основаниями, идет до конца, если в процессе реакции выпадает осадок или образуется газ.
Ионы солей, образованных сильными кислотами и основаниями, не образуют с ионами воды малодиссоциирующих соединений, поэтому не гидролизуются, раствор при этом остается нейтральным.
Соли, образованные двух(трех)основными кислотами и(или) двух(трех)кислотными основаниями гидролизуются ступенчато.
Ступенчатый гидролиз
1) Соль образована слабой многоосновной кислотой и сильным основанием — кол-во ступеней такого гидролиза зависит от основности слабой кислоты.
В качестве примера разберем гидролиз карбоната калия K2CO3.
Соль образована слабой двухосновной кислотой (H2CO3) и сильным основанием (KOH), поэтому, ее гидролиз протекает по аниону (см. выше).
Поскольку кислота H2CO3 является двухосновной, то и гидролиз будет двухступенчатым.
Первая ступень гидролиза карбоната калия:
K2 CO3 + H OH ↔ KOH+K HCO3
Продуктами первой ступени гидролиза карбоната калия являются гидроксид калия (KOH) и кислая соль (KHCO3).
Сокращенное ионное уравнение первой ступени гидролиза:
Вторая ступень гидролиза карбоната калия:
K2 HCO3 + H OH ↔ KOH+ H2CO3
Продуктами второй ступени гидролиза карбоната калия является всё тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Сокращенное ионное уравнение второй ступени гидролиза:
Гидролиз второй ступени протекает в значительно меньшей степени, чем гидролиз первой ступени. Поскольку в процессе гидролиза увеличивается концентрация гидроксид-ионов, среда раствора получившейся соли K2CO3 является щелочной.
2) Соль образована сильной кислотой и слабым многокислотным основанием — кол-во степеней такого гидролиза определяется кислотностью слабого основания.
В качестве примера разберем гидролиз хлорида никеля NiCl2 (II).
Соль образована сильной кислотой (HCl) и слабым основанием (Ni(OH)2), поэтому, ее гидролиз протекает по катиону (см. выше).
Первая ступень гидролиза хлорида никеля в ходе которой катионы никеля связывают гидроксид-ионы воды:
Ni Cl2+H OH ↔ NiOH Cl+HCl
Продуктами первой ступени гидролиза хлорида никеля являются сильная кислота (HCl) и основная соль(NiOHCl).
Сокращенное ионное уравнение первой ступени гидролиза:
Вторая ступень гидролиза:
NiOH Cl+H OH ↔ Ni(OH)2 +HCl
Продукты второй ступени гидролиза хлорида никеля являются сильная кислота и слабое основание.
Сокращенное ионное уравнение второй ступени гидролиза:
Гидролиз второй ступени протекает в значительно меньшей степени, чем гидролиз первой ступени. Поскольку в процессе гидролиза увеличивается концентрация ионов водорода, среда получившегося раствора NiCl2 является кислой.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
http://buzani.ru/zadachi/khimiya-glinka/1198-konstanta-gidroliza-soli-zadachi-537
http://chemege.ru/soli-ammoniya/