Углерод
Содержание:
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др). ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА. Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Углерод и его соединения
Охарактеризуйте углерод по его месту в Периодической системе. Назовите соединения углерода и валентность углерода в этих соединениях.
Углерод в виде угля, копоти, сажи известен человечеству с незапамятных времен. Элементарная природа углерода была установлена А. Лавуазье в конце 1780-х годов. Свое название элемент получил в 1824 г., в переводе с латинского оно означает «уголь».
Положение в периодической системе. Углерод – элемент 2-го периода главной подгруппы IV группы (IVА), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов 
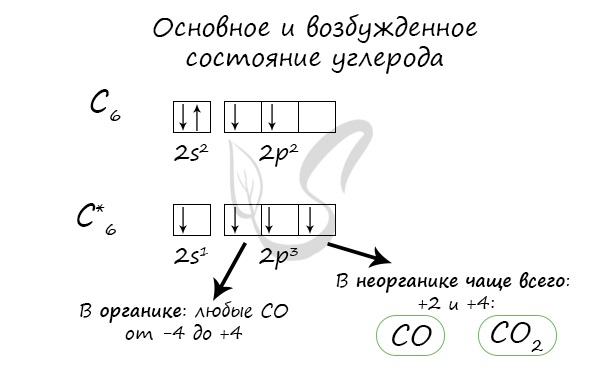
Строение атома. Электронная конфигурация атома углерода: 

Валентные электроны (II, IV) размещены по орбиталям:
При возбуждении один электрон переходит с 2s-подуровня на 2p-подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CО), а в возбужденном состоянии – четырехвалентен
Нахождение в природе. Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода – доломит 


В свободном виде углерод не токсичен, а вот многие его соединения обладают значительной токсичностью.
Аллотропные видоизменения углерода характеризуются различным строением кристаллических решеток. Этим и объясняется резкое различие их физических свойств.
Физические свойства. Алмаз – самое твердое природное соединение на Земле. Это прозрачное, бесцветное, кристаллическое вещество, имеет тетраэдрическое строение, не электропроводен.
Графит – мягкий, непрозрачный, серого цвета, маслянистый и блестящий (рис. 68). Графит при температуре 2000оС и низком давлении превращается в карбин.
В последние годы открыли еще одну форму – фуллерен. У него структура‚ как у футбольного мяча.
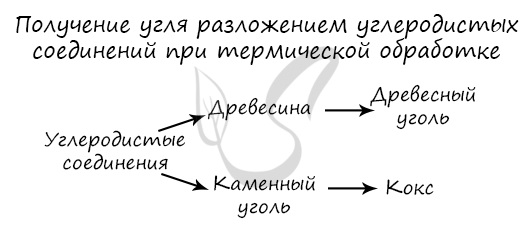
К этим разновидностям можно прибавить аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, у которого сильно выражена способность к адсорбции (поглощение на поверхности) газов, паров и растворенных веществ.
Получение. Сажа – аморфный углерод, продукт неполного сгорания углеводорода. Кокс – твердое искусственное топливо, продукт термической обработки каменного угля.
Запомни! Площадь поверхности активированного угля массой 1 г составляет 800 м2, поэтому он обладает повышенной адсорбционной способностью. Адсорбент — это вещество, способное поглощать на своей поверхности газы и жидкости. Таблетки активированного угля применяют для подготовки желудочно-кишечного тракта к рентгеновскому обследованию и УЗИ; для очистки спирта. Активированный уголь не поглощает угарный газ (СО).
Аллотропные видоизменения углерода.
Химические свойства углерода
Углерод может вступать в реакцию со многими простыми и сложными веществами (схема 9).
Далее приводятся некоторые уравнения реакций с простыми веществами:
1) а) при неполном сгорании углерода:
б) при полном сгорании углерода в избытке кислорода:
2) углерод при освещении соединяется с хлором:
3) с металлами образуются карбиды:
4) с серой образуется сероуглерод:
Сероуглерод применяется для получения вискозного волокна и как растворитель;
5) с водородом образуется метан:
Метан – газообразное топливо (основа природного газа).
Углерод также взаимодействует со сложными веществами:
1) с водой образуется водяной газ, который является ценным топливом.
Именно поэтому уголь смачивают водой, когда топят печь.
2) Углерод с углекислым газом образует оксид углерода (II).
3) С оксидами железа (этот процесс происходит в доменной печи). Углерод выделяет железо в свободном состоянии:
Применение. Алмаз используют для резки стекла, изготовления наконечников буровых установок. Из ограненного алмаза делают великолепные
Графит применяют для изготовления электродов, а также грифелей карандашей. Кокс (С) получают при сухой перегонке (нагревание без доступа воздуха). Используется в производстве металлов как восстановитель. Адсорбционная способность активированного угля находит применение в медицине, а также в противогазах (рис. 69).
Фуллерены – это наночастицы, имеющие очень ценные особенности.
Каждая молекула содержит 60 атомов углерода, упорядоченных в виде пяти и шестиугольников и позволяет изготавливать кристаллы, которые применяются в электронике, в компьютерах.
Практическая работа №6
Физические и химические свойства углерода
Цель: Знать условия образования диоксида и монооксида углерода при сжигании углерода.
Ход работы
Опыт 1. изучение древесного угля
1. В коническую колбу налейте водный раствор какой-нибудь краски.
2. Всыпьте в раствор 0,3–0,5 г мелко истолченного древесного угля, взболтайте содержимое в течение 2–3 минут.
3. Отфильтруйте, наблюдайте исчезновение окраски.
Опыт 2. Восстановительные свойства угля.
1. Примерно одинаковые по массе порции оксида меди (II) и измельченного древесного угля перемешать на листе бумаги.
2. Смесь пересыпьте в сухую пробирку, укрепите горизонтально в штативе.
3. Закройте пробирку пробкой с газоотводной трубкой, изогнутой под прямым углом.
4. Конец трубки опустите в раствор известковой воды.
5. Пробирку сильно нагрейте до прекращения выделения газа.
6. Дайте пробирке остыть, отметьте цвет содержимого.
Вопросы и задания
1. Как изменился цвет раствора красителя? Дайте объяснения.
2. Напишите уравнения реакций опыта №2.
3. Каким химическим свойством обладает углерод?
Оксиды углерода
Какие оксиды углерода вы знаете? К каким оксидам они относятся? Какой из оксидов углерода (II, IV) тяжелее воздуха?
Углерод образует два оксида: угарный газ СО и углекислый газ 
Оксид углерода (II) – угарный газ СО.
Впервые он был получен французским химиком Жаком де Лассаном в 1776 году при нагревании оксида цинка с углем.
Нахождение в природе. В естественных условиях, на поверхности Земли, СО образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, например, при лесных и степных пожарах.
В атмосфере СО является продуктом ряда реакций с участием метана и других углеводородов. Основным антропогенным источником СО служат выхлопные газы двигателей внутреннего сгорания.
Получение:
Физические свойства. Оксид углерода (II) – бесцветный, плохо растворимый в воде ядовитый газ, чуть легче воздуха 
Химические свойства. Угарный газ СО – несолеобразующий оксид. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами. При нагревании он восстанавливает металлы из их оксидов:
Оксид углерода (II) на воздухе горит голубоватым пламенем:
Оксид углерода (IV) – углекислый газ 
Оксид углерода не поддерживает горения. Он используется при огнетушении. Выделяется при дыхании животных и человека. Из-за того что углекислый газ тяжелее воздуха, он накапливается в подвалах, шахтах, колодцах. Углекислый газ легко переходит в жидкое (при давлении 50 атм.), а затем в твердое состояние («сухой лед»). Углекислый газ, растворенный
в воде, придает воде кислый привкус (рис. 71).
Графическая формула: O = C = OКонцентрация углекислого газа в атмосфере Земли
составляет 0,039%. При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации до 3% у человека наблюдается учащенное дыхание, более 10% – потеря сознания и даже смерть.
Повышение концентрации углекислого газа в атмосфере вызывает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере растет из-за автомобильного транспорта, количество которого увеличивается из года в год.
Получение:
1) при сгорании углерода:
2) при разложении карбонатов:
3) из карбонатов под действием сильных кислот (рис. 73):
Это лабораторный способ получения 
4) при разложении основных солей:
5) при горении органических веществ:
Химические свойства. 


1) с основными оксидами образует соли:
2) с растворимыми основаниями образуются соль и вода:
Гидроксид кальция (известковая вода) является реагентом на углекислый газ (выделяется белый осадок). Помутнение известковой воды – качественная реакция на 
3) при избытке углекислого газа карбонат превращается в растворимую кислую соль:
4) с водой образуется слабая, неустойчивая угольная кислота:
Применение. Углекислый газ 
Угарный, углекислый газы; ПДК угарного газа, метан, физические и химические свойства оксидов углерода, качественная реакция на
Практическая работа №7
Получение углекислого газа и изучение его свойств
Цель: получить углекислый газ, доказать его наличие и изучить свойства.
Ход работы
1. В пробирку с газоотводной трубкой положите кусочки мрамора и налейте раствор соляной кислоты, наблюдайте выделение газа (рис. 73).
2. Наполните два сухих стакана углекислым газом. Каким способом его можно собирать? Наполненность проверьте горящей лучиной и затем закройте стеклянными пластинками.
3. В сухой стакан бросьте кусочек ваты, смоченной спиртом, и подожгите его горящей лучинкой.
4. Затем возьмите стакан с углекислым газом и осторожно перелейте в стакан, где горит вата? Что происходит?
5. В стакан, наполненный углекислым газом, поместите подожженную магниевую ленту, держа ее шипцами. Наблюдайте за горением магния.
6. Продукты реакции залейте разбавленным раствором соляной кислоты. Что остается на дне стакана?
Вопросы и задания
1. Напишите все уравнения реакций, определите типы реакций.
2. К каким оксидам относится углекислый газ?
3. Можно ли собирать углекислый газ методом вытеснения воды? Ответ мотивируйте.
4. Углекислый газ тяжелее или легче воздуха? На каких этапах работы вы это наблюдали?
- 1. Углерод встречается в четырех аллотропных видоизменениях (алмаз, графит, карбин). Фуллерен — это искусственная модификация углерода, не существующая в природе.
- 2. В соединениях углерод проявляет валентность II, IV (СН4, СО, со2).
- 3. СО — угарный (ядовитый) газ, несолеобразующий оксид. СО., -кислотный оксид.
- 4. Углекислому газу соответствует угольная кислота Н„СО3. Она непрочная, разлагается. Соли этой кислоты называются карбонатами.
- 5. Активированный уголь — хороший адсорбент.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Углерод
Углерод
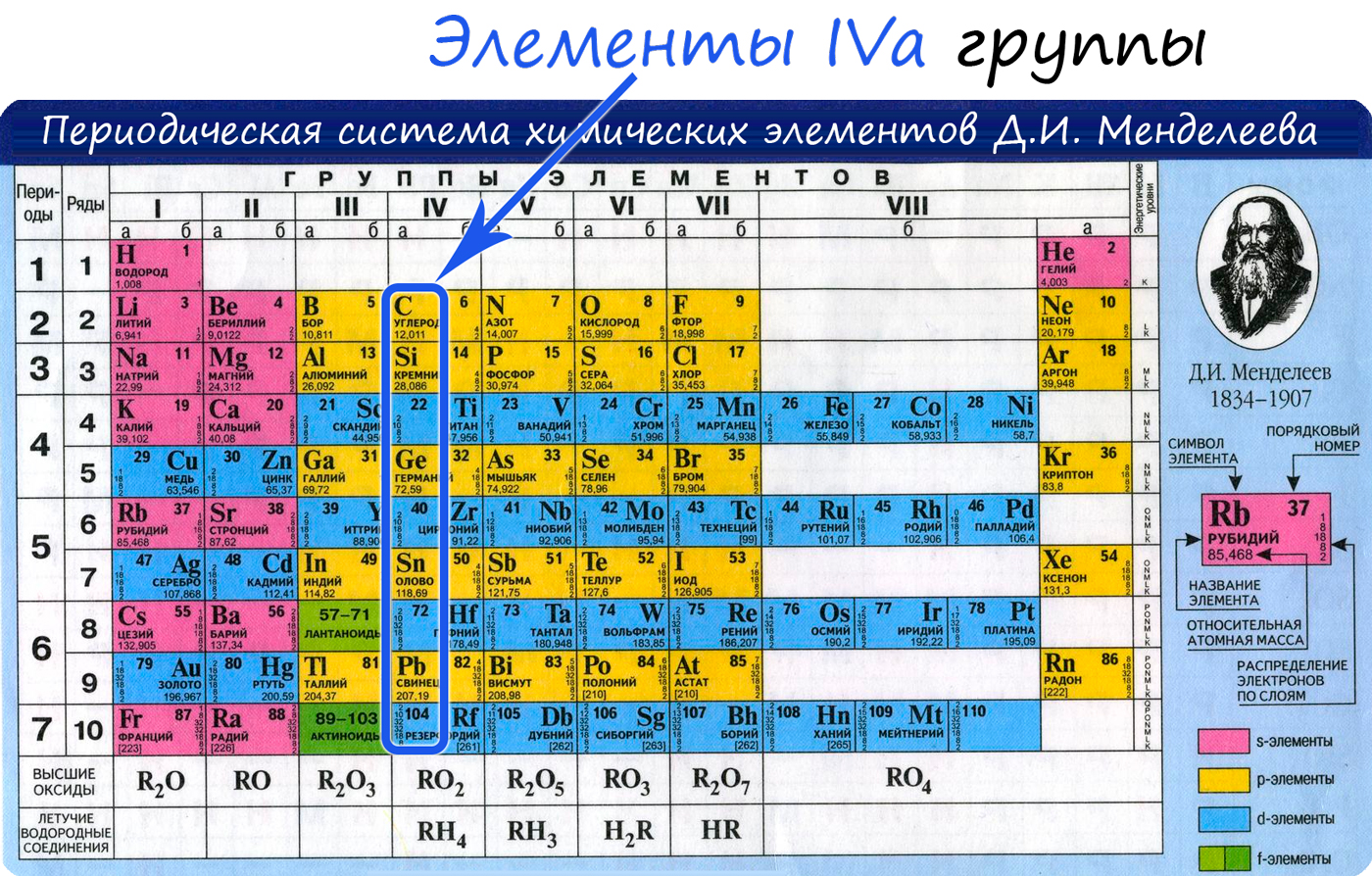
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 2 :
- C — 2s 2 2p 2
- Si — 3s 2 3p 2
- Ge — 4s 2 4p 2
- Sn — 5s 2 5p 2
- Pb — 6s 2 6p 2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
Химические свойства
- Реакции с неметаллами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
Реакции с металлами
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
Реакции с кислотами
В реакциях с кислотами углерод проявляет себя как восстановитель:
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
- Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
Реакции с основными оксидами и основаниями
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
Нагревание солей угольной кислоты
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://chemege.ru/kislorod/
http://studarium.ru/article/166