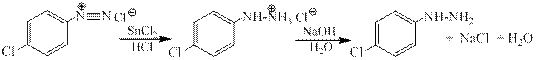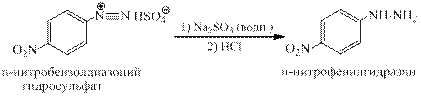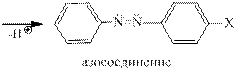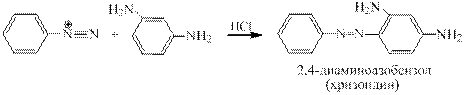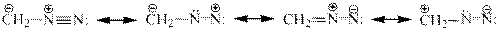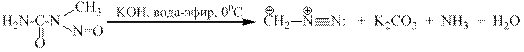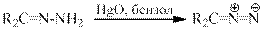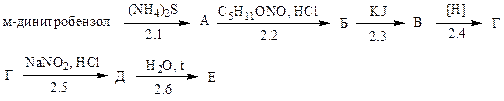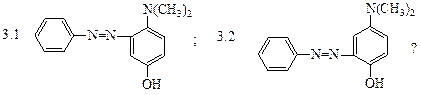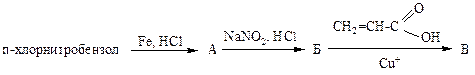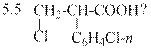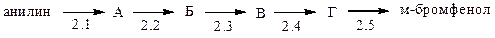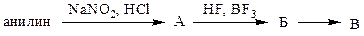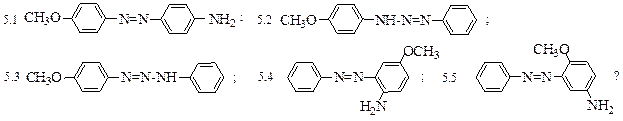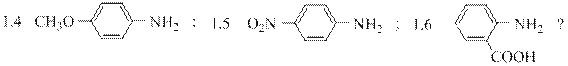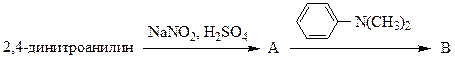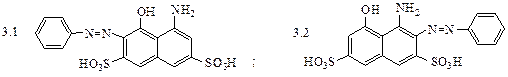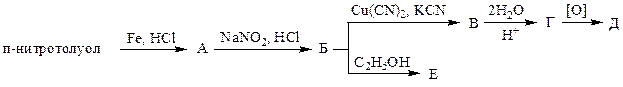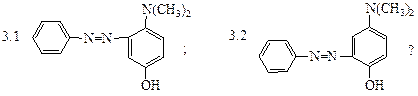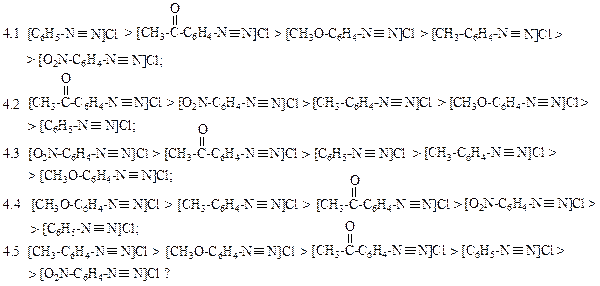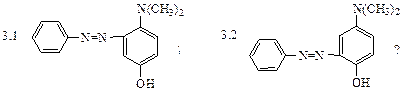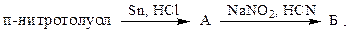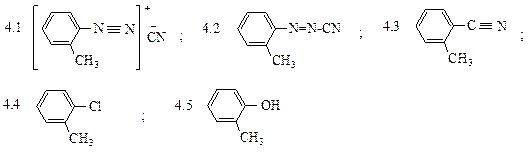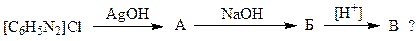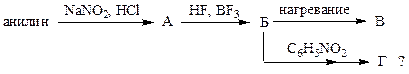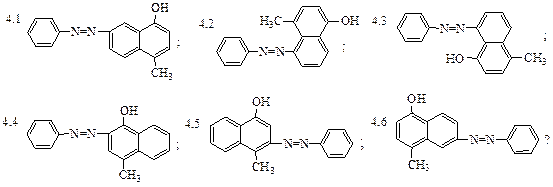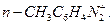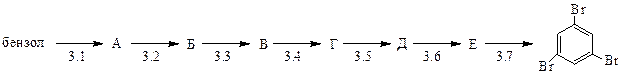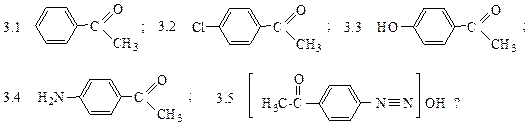Йодбензол
| Йодбензол | |||
|---|---|---|---|
| |||
| Хим. формула | C6H5I | ||
| Состояние | Бесцветная жидкость | ||
| Плотность | 1,823 г/см³ | ||
| Температура | |||
| • плавления | −29 °C | ||
| • кипения | 188 °C | ||
| • вспышки | 74,44 °C | ||
| Рег. номер CAS | 591-50-4 | ||
| PubChem | 11575 | ||
| Рег. номер EINECS | 209-719-6 | ||
| SMILES | |||
| RTECS | DA3390000 | ||
| ChemSpider | 11087 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Содержание
- 1 Получение
- 2 Реакции
- 3 Применение
Получение
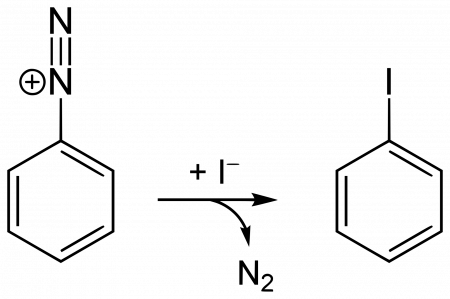
Йодбензол есть в продаже, так что в лаборатории получать его нет необходимости. Но если нужно, получают йодбензол из анилина по реакции Зандмейера. Первой стадией амино-группа диазотируется хлороводородной кислотой и нитритом натрия. К получающемуся фенилдиазоний хлориду добавляют йодид калия, в результате чего азот выделяется в свободном виде. Получившийся йодбензол отделяют паровой дистилляцией.
Также можно получить йодбензол напрямую из бензола, прилив к нему смесь йода и азотной кислоты.
Реакции
Поскольку связь C-I слабее, чем у других галогенов с углеродом, у йодбензол гораздо выше реакционная способность, чем у бром- или хлорбензола. Йодбензол легко реагирует с магнием, образуя реактив Гриньяра, фенилмагний йодид. Фенилмагний йодид, также как и его бромидный аналог, выступает эквивалентом фенила при рассмотрении синтонов.
Также йодбензол может выступать в качестве субстрата в реакции Соногаширы, Хека и других металл-каталитических реакциях.
Применение
В лабораториях иногда в качестве твёрдого источника хлора используют комплекс йодбензола дихлорида, получаемого реакцией йодбензола с хлором.
Ароматические диазосоединения
Вы будете перенаправлены на Автор24
Ароматические диазосоединения — это вещества общей формулы $[R-N^+\equiv N]X^-$ или $R-N^+\equiv NX^-$, в молекулах которых диазогрупа соединена одновременно с атомом углерода ароматического ядра и неорганическим остатком $X$ — анионом кислот $Cl^-$, $
- соли диазония $R-N^+\equiv N^*X^-$,
- диазопроизводные типа $Ar-N = N-X$ и
- диазотаты $Ar-N = N-O^-M^+$.
Соли диазония
Важнейшими из диазосоединений являются соли диазония $R-
Соли арендиазония представляют собой типичные ионные кристалические вещества, растворимость которых в воде и спиртах определяется главным образом природой аниона $X^-$. В воде обычно хорошо растворимы галогениды и сульфаты арендиазония, соли же с комплексным анионом характеризуются низкой растворимостью.
Названия солей диазония состоят из названия ароматического остатка или углеводорода 1, к которому добавляется окончание -диазо 2 с указанием названия аниона 3:
Диазокатион $Ar-N_2$ или $[Ar-N\equiv N]^+$, является сопряженным ионом, в котором проявляется значительное взаимодействие между $\pi$-электронами бензольного кольца и тройной связью диазогрупы. Диазогрупа — более сильный электронноакцептор, чем $NO_2$-группа. Положительный заряд сосредоточен в основном на ближайшем от бензольного ядра атоме азота:
Готовые работы на аналогичную тему
Однако вследствие индукционного действия бензольного кольца, а также сопряжения с ним азогруппы на крайнем атоме азоту также существует некоторый положительный заряд ($\delta +$). Этот заряд увеличивается под влиянием электроноакцепторных заместителей в бензольном ядре и уменьшается в случае электронодонорных, что существенно влияет на реакционную способность диазокатиона. В результате частичного смещения электронных облаков в бензольном цикле связи $C-N$ и $N\equiv N$ приобретают в какой-то мере черты двойных связей.
Строение диазокатиона, который характеризуется линейной структурой, может быть показано набором резонансных структур:
Наибольший вклад в реальное строение диазокатиона VI принадлежит, как полагают, структуре 1, что подтверждается длинами связей $C-N$ и $N\equiv N$ как одинарной и тройной соответственно.
Диазотаты
Особым случаем солей диазониевых солей является соль гидроксида диазония, $[Ar-N = N]$ $OH$, которая никогда не была выделена. Когда раствор соли диазония подщелачивают, гидроксид диазония быстро перестраивается в диазогидроксид, соли которого называются диазотатами (диазолатами). Механизм этих изменений может быть следующим:
В реакциях электрофильного замещения в щелочной среде из солей диазония образуется не способные к азосочетанию диазотат-анионы:
Диазотаты в противоположность солям диазония являются стабильными соединениями. При подкислении раствора диазотата можно, в результате обратной реакции, получить диазосоединение. Диазотаты и диазогидроксиды могут существовать в двух формах — син- (нормальной) и анти- (изо-).
Син-форма, п-диазотат, получают в слабо щелочном растворе и она является неустойчивой и постепенно переходит в анти · форму — изо-диазотат. Это изменение ускоряется путем введения в раствор более сильной щелочни.
Фенилдиазонийхлорид
Фенилдиазонийхлорид представляет собой органическое соединение с формулой $[C_6H_5N_2]Cl$.
Он представляет собой соль состоящую из катиона — диазония и хлориданиона. Фенилдиазонийхлорид существует в виде бесцветного твердого вещества, которое растворимо в полярных растворителях, включая воду. В твердом состоянии фенилдиазонийхлорид имеет следующую структуру:
Это одно из основоположных арендиазониевых соединений, которое широко используются в области органической химии. Так как эта соль нестабильна, она не является коммерчески доступным продуктом, но ее легко можно полуить в лабораторных условиях.
Это соединение получают путем диазотирования анилина. Преобразование включает использование азотистой кислоты ($HNO_2$), которыая вступает в реакцию с анилином:
$C_6H_5NH_2 + HNO_2 + HCl \to [C_6H_5N_2]Cl + 2 H_2O$
Реакцию проводят при низкой температуре, чтобы свести к минимуму разложение соли диазония.
Диазонийхлорид также могжет быть получен путем обработки сложных эфиров нитритов с анилином в присутствии $HCl$.
$C_5H_<11>ONO + HCl + C_6H_5NH_2 \to [C_6H_5N_2]Cl + C_5H_<11>OH + H_2O$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 22 03 2021
Реакция солей арилдиазония без выделения азота
Восстановление солей арендиазония в арилгидразины. Существует два общих метода восстановления солей диазония до арилгидразинов. Первый из них заключается в восстановлении катиона арендиазония смесью сульфита и гидросульфита натрия. Другой способ состоит в восстановлении солей диазония двухлористым оловом в соляной кислоте.
При наличии в ароматическом ядре нитрогруппы восстановление проводят сульфитом натрия
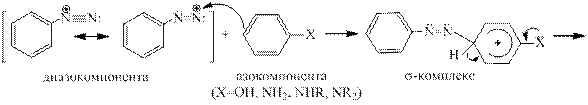
Реакция азосочетания. Это наиболее важная в практическом отношении реакция ароматических диазосоединений. Соли диазония реагируют с фенолами и ароматическими аминами с образованием ярко окрашенных азосоединений, в которые два ароматических кольца связаны азогруппой — N = N -. В этой реакции следует различать диазо- (ArN2 + ) и азо- (ArX) составляющие. Азосочетание относится к типичным реакциям электрофиль- ного ароматического замещения, скорость которой зависит как от электрофильных свойств катиона диазония, так и от электронодонорных свойств азосоставляющей. Катион арендиазония относится к числу слабых электрофильных агентов, так как его положитель- ный заряд делокализован за счет сопряжения с ароматическим кольцом. Как слабый элек- трофильный агент катион диазония взаимодействует только с производными бензола и нафталина, содержащими сильные электронодонорные заместители, т.е. с феноксид-ионами, фенолами и аминами. Моноалкилбензолы вообще не вступают в реакцию азосочетания.
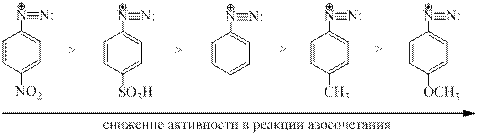
Реакционная способность катиона арендиазония в большой степени зависит от природы заместителей в бензольном кольце. Электроноакцепторные заместители увеличивают, а электронодонорные уменьшают электрофильные свойства катиона диазония.
Влияние заместителей на активность диазокатиона:
Для каждой реакции азосочетания имеется оптимальное значение рН. Для сочетания аминов наиболее благоприятной является рН 4-8, для фенолов — рН 8-10.
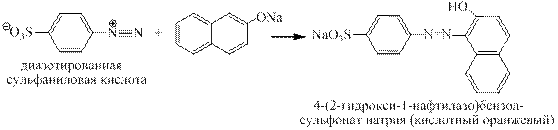
Синтез кислотного оранжевого. Азосочетание проводится в щелочной среде:
Синтез хризоидина. Азосочетание проводится в слабокислой среде:
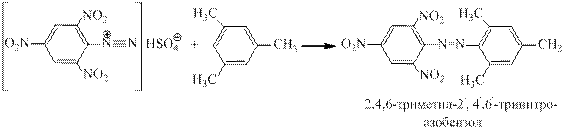
Соли диазония, имеющие в кольце сильные электроноакцепторные заместители сочета- ются с субстратами, у которых отсутствуют сильные ЭД группы, например, с мезитиле-
Азокрасители используются для окрашивания тканей. Ниже приведены некоторые примеры азокрасителей, используемых при крашении естественных волокон — шерсти и хлопка: п-нитроанилиновый красный, пунцовый 2R, кислотный красный С, нафтилоранж.
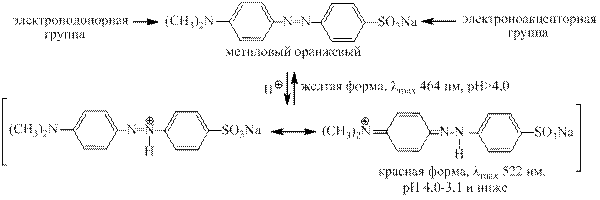
Протонирование азогруппы в аминоазосоединениях сопровождается резким углубле- нием окраски. Это изменение окраски называют индикаторным переходом и используют
при титровании. В качестве индикаторов применяют метиловый оранжевый, метиловый красный, конгокрасный и другие.
Алифатические диазосоединения (диазоалканы). Строение алифатических диазосое- динений может быть выражено общей формулой R2C=N + =N — . Отрицательный заряд в диазоалкане распределен между концевым атомом азота и углеродом в результате мезо- мерного эффекта R2C = N + = N — , что отражает его свойства как нуклеофильного реагента.
При протонировании или при взаимодействии с кислотами Льюиса образуется электро- нодефицитная частица, обладающая свойствами мощного электрофильного агента, поэтому для диазоалканов характерны свойства бифильного реагента. Диазоалканы отно- сятся к числу реакционноспособных и нестабильных соединений. Раствор диазометана в эфире сохраняется при -20 о в течение длительного времени.
Получение диазоалканов. Лучшим в настоящее время способом получения диазометана остается метод обработки N- нитрозометилмочевины концентрированным раствором щелочи при 0-5 о . Образующийся при этом газообразный диазометан хранят в растворе в эфире при 0-(-20 о ).
Диазосоединения могут быть получены также окислением соответствующих гидразонов желтой окисью ртути в эфире или бензоле.
Свойства диазоалканов. Диазометан и другие диазоалканы количественно реагируют с гидроксильной группой карбоновых кислот, фенолoв и енолов, а при катализе эфиратом трехфтористого бора и со спиртами в эфирном растворе при -10 –( -20 o ).
Предполагается, что в каждой из этих реакций в первой стадии происходит перенос протона к диазометану с образованием крайне нестабильного катиона метилдиазония CH3N2 + , который затем взаимодействует с карбоновой кислотой или другим нуклеофиль- ным агентом с образованием конечного продукта метилирования.
Задания для программированного контроля знаний студентов
1. Почему при проведении реакции диазотирования необходим избыток минеральной кислоты:
1.1 увеличивается электрофильная реакционная способность азотистой кислоты;
1.2 образуется катион нитрозония; 1.3 образуется азотистый ангидрид;
1.4 образуется соль амина; 1.5 образуется соль диазония?
2. Расшифруйте схему превращений:
Укажите реакции, при которых образуются диазосоединения:
2.1; 2.2; 2.3; 2.4; 2.5; 2.6.
Какое вещество соответствует продукту Е:
2.7 азосоединение; 2.8 фенол; 2.9 анилин; 2.10 иодбензол; 2.11 нитробензол?
3. Избирательность реакции азосочетания в зависимости от pH среды позволяет получить
различные азосоединения. Какой продукт получится при сочетании соли фенилдиазония с п-N,N-диметиламинофенолом при рН=10:
4. Какой ряд аминов соответствует уменьшению легкости их диазотирования:
4.1 п-толуидин > п-нитроанилин > анилин > 2,4-диметиланилин > 2,4-динитроанилин;
4.2 2,4-диметиланилин > п-толуидин > анилин > п-нитроанилин > 2,4-динитроанилин;
4.3 2,4-динитроанилин > 2,4-диметиланилин > п-нитроанилин > анилин > п-толуидин;
4.4 анилин > п-толуидин > п-нитроанилин > 2,4-диметиланилин > 2,4-динитроанилин;
4.5 п-нитроанилин > 2,4-динитроанилин > анилин > 2,4-диметиланилин > п-толуидин ?
5. Какой из изомерных фенилендиаминов обладает наибольшей склонностью к реакциям азосочетания:
5.1 о-фенилендиамин; 5.2 м-фенилендиамин; 5.3 п-фенилендиамин ?
По какому механизму идет реакция азосочетания:
5.4 нуклеофильное замещение; 5.5 электрофильное замещение; 5.6 радикальное
1. Какое из веществ является диазотирующим агентом в реакциях диазотирования аминов:
1.1 азотистая кислота; 1.2 азотистый ангидрид; 1.3 катион нитрозония;
1.4 хлористый нитрозил; 1.5 сложный эфир азотистой кислоты?
2. С помощью каких реакций можно получить салициловую кислоту из анилина ?
Напишите уравнения реакций, укажите механизм второй стадии реакции:
2.1 электрофильное замещение; 2.2 нуклеофильное замещение;
2.3 электрофильное присоединение; 2.4 нуклеофильное присоединение;
2.5 радикальная реакция.
3. Почему ароматические амины вступают в реакцию азосочетания в слабокислой среде:
3.1 амины образуют соли; 3.2 соль диазония разрушается;
3.3 в реакцию вступает амин; 3.4 разрушается ароматический амин;
3.5 азосоединение более устойчиво?
4. Какой амин легче вступает в реакцию азосочетания с хлористым фенилдиазонием:
4.1 N,N-диметиланилин; 4.2 N,N,2,6-тетраметиланилин?
Чем можно объяснить: 4.3 влиянием заместителей; 4.4 стерическими факторами?
5. Расшифруйте схему превращений:
Напишите уравнения реакций. Какое вещество соответствует В:
1. Почему реакцию диазотирования проводят при низкой температуре:
1.1 повышается устойчивость соли диазония;
1.2 смещается равновесие реакции в сторону образования соли диазония;
1.3способствует получению диазотирующего агента;
1.4 амин, вступающий в реакцию диазотирования, активируется;
1.5 способствует образованию соли амина?
2. Получите м-бромфенол из анилина по схеме:
Укажите реакцию диазотирования: 2.1; 2.2; 2.3; 2.4; 2.5.
3. Почему фенолы вступают в реакцию азосочетания в слабощелочной среде (рН=9-10):
3.1 разрушается соль диазония; 3.2 образуется фенолятион;
3.3 разрушается азосоединение; 3.5 в реакцию вступает фенол?
4. Что произойдет с диазосоединением, если его раствор оставить на несколько часов при
4.1 изменений не произойдет; 4.2 образуется хлорбензол;
4.3 образуется фенол; 4.4 диазосоединение разрушится?
5. Какие соединения могут выступать азосоставляющей:
5.1 N-метиланилин; 5.2 N,N-диметиланилин; 5.3 фенол;
5.4 1,3,5-триметилбензол; 5.5 уксусная кислота?
1. Расшифруйте схему превращений:
Напишите уравнения реакций. Какое вещество соответствует В:
1.1 фенол; 1.2 фторбензол; 1.3 хлорбензол; 1.4 нитроанилин; 1.5 бензол?
Укажите условия получения продукта В:
1.6 термическое разложение абсолютно сухого Б; 1.7 охлаждение; 1.8 термическое разложение без предварительного высушивания; 1.9 воздействие основных реагентов; 1.10 воздействие кислых реагентов.
2. В каких условиях следует проводить сочетание 1-амино-5-нафтола, чтобы диазониевая
группа атаковала кольцо, содержащее аминогруппу:
2.1 рН=10; 2.2 pH=6; 2.3 pH=7; 2.4 pH=3; 2.5 pH=12 ?
Напишите реакцию азосочетания.
3. При диазотировании анилина вместо прозрачного раствора был получен осадок желтого
цвета, Какая ошибка была допущена при проведении реакции:
3.1 не выдержана температура диазотирования; 3.2 недостаток кислоты;
3.3 реакция проведена в щелочной среде; 3.4 реакция проведена в нейтральной
4. Известно, что спирты реагируют с солями диазония двояко: с образованием эфиров фенолов (А) и заменой диазогруппы на водород (Б). Как будет меняться выход продукта Б, если в п-положении к диазогруппе в соли диазония будут находиться: СH3; NO2; OCH3; SO3H; N(CH3)2:
4.1 уменьшается при переходе от электронодонорных к электроакцепторным
4.2 уменьшается при переходе от электроноакцепторных к электронодонорным
4.3 введение заместителя не влияет?
5. Какое соединение образуется при азосочетании хлористого фенилдиазония с п-анизиди-
ном в слабощелочной или нейтральной среде:
1. Укажите, какие амины можно диазотировать «прямым» методом:
2. Напишите уравнения реакций в соответствии со схемой:
По какому механизму образуется В:
2.1 электрофильное замещение; 2.2 нуклеофильное замещение; 2.3 электрофильное присоединение; 2.4 нуклеофильное присоединение; 2.5 радикальная реакция?
3. Какой продукт получится при сочетании соли фенилдиазония с соединением
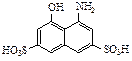
4. Что получится при восстановлении солей диазония:
4.1 анилин; 4.2 бензол; 4.3 фенилгидразин; 4.4 циклогексиламин?
5. Ароматический углеводород азулен:
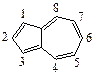
5.1 1; 5.2 2; 5.3 3; 5.4 4; 5.5 5; 5.6 6; 5.7 7; 5.8 8 ?
1. Укажите, какие амины диазотируют «обратным» методом:
2. Напишите уравнения реакций в соответствии со схемой:
Укажите диазосоединение: 2.1 А; 2.2 Б; 2.3 В; 2.4 Г; 2.5 Д; 2.6 Е.
3. Какой продукт получится при сочетании соли фенилдиазония с п-N,N-диметиламино- фенолом при рН=6:
4. Какой порядок изменения активности диазосолей при их разложении водой является правильным:
5. При кипячении диазониевой соли антраниловой кислоты (о-аминобензойной) с одним эквивалентом иода образуется о-дииодбензол. Напишите уравнение реакции и укажите механизм образования о-дииодбензола:
5.1 электрофильное замещение; 5.2 нуклеофильное замещение; 5.3 электрофильное присоединение; 5.4 нуклеофильное присоединение; 5.5 радикальная реакция.
1. С помощью каких реакций можно получить п-бромбензойную кислоту из п-толуидина? Напишите уравнения реакций, укажите механизм реакции введения галогена:
1.1 электрофильное замещение; 1.2 нуклеофильное замещение; 1.4 электрофильное присоединение; 1.4 нуклеофильное присоединение; 1.5 радикальная реакция.
2. Какие соединения могут выступать азосоставляющей:
2.1 N-метиланилин; 2.2 N,N-диметиланилин; 2.3 фенол;
2.4 1,3,5-триметилбензол; 2.5 бензол; 2.6 уксусная кислота?
3. Избирательность реакции азосочетания в зависимости от рН среды позволяет получить различные азосоединения. Какой продукт получится при сочетании соли фенилдиазония с п-N,N-диметиламинофенолом при рН=10:
4. Расшифруйте схему:
Какова структура Б:
5. Какие продукты образуются при обработке холодного раствора соли диазония эквивалентным количеством водного раствора гидроксида натрия:
5.1 фенол; 5.2 Ar-N=N-OK; 5.3 Ar-N=N-OH; 5.4 Ar-NH-N=O;
5.5 фенолят калия; 5.6 бензол?
1. Как меняется скорость азосочетания в зависимости от строения диазокомпоненты:
1.1 увеличивается при наличии электроноакцепторных групп в о- и п-положении;
1.2 увеличивается при наличии электроноакцепторных групп в м-положении;
1.3 увеличивается при наличии электронодонорных групп;
1.4 уменьшается при наличии электронодонорных групп;
1.5 заместители не влияют на скорость реакции?
2. Какие превращения происходят с хлоридом диазония при последовательном действии влажной окиси серебра, щелочи, а затем кислоты по схеме:
Какое соединение называют диазогидратом:
Как будет меняться электропроводность растворов (исходного, А, Б и В):
2.4 не изменяется при переходе от одного соединения к другому; 2.5 уменьшается;
2.6 не наблюдается; 2.7 увеличивается?
3. Расшифруйте схему превращений:
Напишите уравнения реакций. По какому механизму образуются В и Г:
3.1 нуклеофильное замещение; 3.2 электрофильное замещение; 3.3 радикальное замещение; 3.4 нуклеофильное присоединение; 3.5 электрофильное присоединение?
4. Какое азосоединение получится при сочетании хлористого фенилдиазония с 4-метил-нафтолом-1:
5. Хлористый фенилдиазоний разлагается в кислой водной среде с образованием двух соединений А и Б. Добавление хлорида натрия не влияет на скорость разложения (определенную по скорости выделения азота), но количество вещества А сильно возрастает. По какому механизму идет разложение соли диазония:
5.1 электрофильное замещение; 5.2 нуклеофильное замещение;
5.3 электрофильное присоединение; 5.4 нуклеофильное присоединение?
1. Укажите более активный катион диазония в реакциях азосочетания с N,N-диметиланилином:
1.1 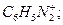
Какое вещество получится в результате реакции с выбранным катионом:
1.3 4-диметиламинодифенил; 1.4 п-диметиламинодифенил;
1.5 4-диметиламиноазобензол; 1.6 4-метил-4-диметиламиноазобензол?
2. Объясните, почему при разложении хлористого фенилдиазония в присутствии акрилонитрила образуется 2-хлор-3-фенилпропионитрил. Каково действие соли одновалентной меди:
2.1 способствует образованию катиона; 2.2 способствует образованию аниона;
2.3 способствует образованию радикала; 2.4 не влияет на ход реакции?
3. Используя реакцию диазотирования. напишите уравнения реакций по схеме:
Укажите реакцию диазотирования: 3.1; 3.2; 3.3; 3.4; 3.5; 3.6; 3.7.
4. В каких условиях следует проводить сочетание 1-амино-5-нафтола, чтобы диазогруппа атаковала кольцо, содержащее аминогруппу:
4.1 pH=10; 4.2 pH=6; 4.3 pH=3; 4.4 pH=7; 4.5 раствор уксусной кислоты;
5. Какой из изомерных фенилендиаминов обладает наибольшей склонностью к реакциям азосочетания:
5.1 о-фенилендиамин; 5.2 м-фенилендиамин; 5.3 п-фенилендиамин?
По какому механизму идет реакция замещения фенилендиаминов:
5.4 нуклеофильное замещение; 5.5 электрофильное замещение;
5.6 радикальное замещение?
1. Укажите более активный катион диазония в реакциях азосочетания с анилином:
1.1 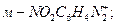
Какое вещество получится в результате с выбранным катионом:
1.3 3-нитро-4 ’ — аминобензол; 1.4 3-нитро-3 ’ -аминоазобензол;
1.5 3-метокси-4 ’ -аминоазобензол; 1.6 3-метокси-3 ’ -аминоазобензол?
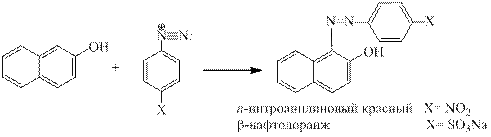
2. β–Нафтол вступает в реакцию азосочетания только за счет положения 1, причем
1-метил-2-нафтол не образует азокрасителя. Чем объяснить факт:
2.1 влиянием заместителя; 2.2 повышенной электронной плотностью в положении 1;
2.3 влиянием второго кольца; 2.4 влиянием среды; 2.5 влиянием растворителя?
3. Хлористый п-ацетилфенилдиазоний разлагается водой в кислой среде с образованием двух соединений. Добавление хлорида натрия не влияет на скорость разложения, но увеличивает количество одного из продуктов. Какие продукты реакции образуются:
Содержание какого из продуктов увеличивается при добавлении хлорида натрия?
4. Как определить конец диазотирования:
4.1 по изменению цвета индикаторной бумажки; 4.2 по выпадению осадка;
4.3 по изменению цвета реакционной массы?
Как удалить из реакционной смеси избыток азотистой кислоты:
4.4 добавить щелочь; 4.5 добавить мочевину; 4.6 добавить сильную кислоту?
5. Предложите путь синтеза 1-фтор-4-бромнафталина из 4-бромнафталина. Укажите условия последней стадии реакции:
5.1 охлаждение; 5.2 действие кислоты; 5.3 действие щелочи;
5.4 действие воды; 5.5 нагревание; 5.6 присутствие галогенида меди (I).
- Агрономов А.Е. Избранные главы органической химии. – М.: Химия, 1990.
- Денисов В.Я., Мурышкин Д.Л., Чуйкова Т.В. Органическая химия. –М: Высш. шк., 2009.
- Морриссон Р., Бойд Р. Органическая химия. М.: Мир, 1974.
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия.- М.: Бином, 2004. В 4-х частях.
- Робертс Дж., Кассерио М. Основы органической химии. М.: Мир, 1978. Т.1,2.
- Терней А. Современная органическая химия: Пер. с англ. –М.: Мир, 1981. -Т. 1,2.
- Травень В.Ф. Органическая химия: Учебник для вузов. – М.: ИКЦ «Академия», 2004. – Т. 1,2.
- Шабаров Ю.С. Органическая химия. – М.: Химия, 2002.
- Курц А. Л., Ливанцов М. В., Чепраков А. В., Ливанцова Л. И., Зайцева Г. С., Кабачник М. М. Задачи по органической химии с решениями. – М.: БИНОМ, 2004.
10. ОРГАНИКУМ, М.: Мир, 2008.
Реакции аминирования, амидирования, диазотирования
и азосочетания органических соединений
Ботиров Эркин Хожиакбарович
Нехорошев Виктор Петрович
Подписано к печати 04.2011 г.
Формат Усл. печ. л. Бумага офсетная.
Гарнитура Times New Roman. Тираж экз. Заказ №
628400, Тюменская область, ХМАО-Югра, г.Сургут, ул. Мира, 54/1.
http://spravochnick.ru/himiya/aromaticheskie_i_alifaticheskie_nitrosoedineniya_diazosoedineniya_i_azidy/aromaticheskie_diazosoedineniya/
http://mydocx.ru/4-15321.html