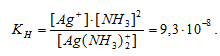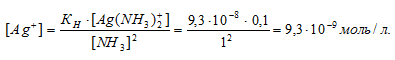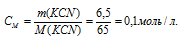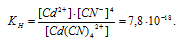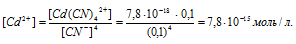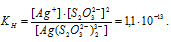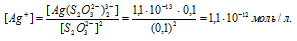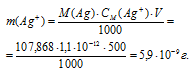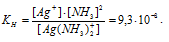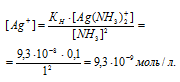Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN)2] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K + и [Ag(NO2)2] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO2)2] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что Kн([Ag(NO2)2] — ) + .
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni 2+ с NH3 образует комплекс [Ni(NH3)6] 2+ , так как Kн (Ni(NH3)6] 2+ ) + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Сd 2+ :
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
Отсюда выражаем концентрацию ионов Ag + :
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: (9,3 . 10 -9 ) . (1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1,1 . 10 -16 , то осадок бромида серебра не образуется.
Сборник описаний лабораторных работ (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 |
Чем меньше значение Кн, тем устойчивее комплексный ион.
3.4.3. Разрушение комплексных ионов
Разрушить комплексный ион – это значит сместить равновесие в схеме его диссоциации в направлении прямого процесса. В зависимости от значений Кн комплексные ионы делятся на:
· устойчивые, если Кн > ПР = 2,2 · 10–20
Чтобы получить осадок CuS, кроме ионов Cu2+ необходимы ионы S2–, которые в достаточном количестве содержатся в любом растворимом в воде сульфиде, например, (NH4)2S; K2S; Na2S и т. д.
[Cu(CO3)2]2–+ K2S → CuS ↓ + 2K+ + 2CO32–
Чтобы получить осадок PbCO3 кроме ионов CO32– (лиганды) необходимы ионы Pb2+, которые в достаточном количестве содержатся в любой растворимой соли свинца (II), например, Pb(NO3)2, Pb(CH3COO)2 и т. д.
[Cu(CO3)2]2– + Pb(NO3)2 → PbCO3↓ + Cu2++ CO32– + 2NO3–
3.5. Жёсткость природных вод
3.5.1. Общие понятия о жёсткости воды
Вода самое распространенное на земле вещество. Вода представляет собой бесцветную, прозрачную жидкость, не имеющую ни запаха, ни вкуса. Вода имеет рН = 7,0; т. е. нейтральный характер. Плотность воды при + 4 0С равна 1 г/см3. Массовый состав воды выражается следующими числами: 11,11 % (мас.) водорода и 88,89 % (мас.) кислорода. Простейшая формула воды Н2О, мольная масса равна 18 г/моль.
Вода является всеобщим универсальным растворителем, поэтому вода никогда не бывает совершенно чистой. Вода содержит растворенные газы, микроорганизмы, растворимые примеси, частицы песка, глины и т. д.
Поэтому существует государственный стандарт (ГОСТ), согласно которому контролируется качество питьевой воды.
Контролю подлежат вкус, запах, цветность и мутность воды, определяется жесткость воды.
Контролируются концентрации в воде железа, мышьяка, азотсодержащих веществ, фторидов, меди, сульфатов, алюминия, активного хлора, свинца, цинка, серебра, бериллия, молибдена, полифосфатов, селена, стронция.
Природная вода, содержащая в растворе большое количество солей кальция и магния в виде гидрокарбонатов и сульфатов, называется жесткой водой. Точнее, жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+. Са2+ и Mg2+ образуют с мылами трудно растворимые соединения. С Синтетическими моющими средствами трудно растворимые соединения образуются в гораздо меньшей степени, но все-таки эффективность синтетических моющих средств в жесткой воде ниже, чем в мягкой. Мягкой называется вода содержащая мало ионов Са2+ и Mg2+ или совсем не содержащая их.
Жёсткость – один из технических показателей, принятых для характеристики состава и качества природных вод. Жесткость простых водоемов колеблется в широких пределах и зависит от типа окружающих почв, сезона года, времени суток.
Жёсткость воды (Ж) выражают количеством миллимоль эквивалентов ионов Ca2+ и Mg2+, содержащихся в 1 дм3 воды.

где 



Общая жесткость определяется суммой частных жесткостей:
Измеряется жёсткость числом миллимолей эквивалентов ионов жесткости (Са2+ и Mg2+) в 1 кг воды. В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммоль/дм3; или ммоль/дм3; или моль/м3. 

По ГОСТ 4151-72 жёсткость не должна превышать 7 моль/м3. Если Жо 7, то вода считается жесткой, если Жо > 14, то вода считается очень жесткой.
Различают жёсткость воды карбонатную, некарбонатную и общую.
Карбонатная (временная) жёсткость ЖВ обусловлена наличием в воде гидрокарбонатов кальция и магния: Са(НСО3)2 и Mg(HCO3)2.
Некарбонатная (постоянная) жёсткость ЖП вызвана присутствием в воде других солей кальция и магния, например хлоридов и сульфатов.
3.5.2. Способы умягчения воды
Процесс устранения (снижения) жёсткости воды называется умягчением воды.
Для умягчения воды используют термический и реагентные методы.
Предусматривает нагревание воды до 95 – 98 ºС. При этом происходит разложение гидрокарбонатов кальция и магния:
Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О.
Магний при нагревании воды осаждается в виде гидроксида или основного карбоната (вследствие гидролиза):
Mg(HCO3)2 = MgCO3 + CO2↑ + H2O,
2MgCO3 + 2H2O = (MgOH)2CO3 + CO2↑ + H2O,
Таким образом, при кипячении воды жесткость, вызываемая присутствием гидрокарбонатов кальция и магния, устраняется и поэтому называется временной – ЖВ. Некарбонатная жесткость не устраняется при кипячении, поэтому ее еще называют постоянной жёсткостью – ЖП.
Связаны с удалением ионов кальция и магния в результате образования малорастворимых соединений под действием химических реагентов. В качестве таких реагентов используют Са(ОН)2 (метод известкования), смесь Са(ОН)2 + NaCO3 (содово-известковый метод), реже – другие вещества.
Гидроксид кальция устраняет карбонатную жесткость:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
Сода устраняет некарбонатную жесткость:
MgCl2 + Na2CO3 + H2O = Mg(OH)2↓ + 2NaCl + CO2↑.
3.5.3. Примеры решения задач
В 10 литрах воды содержится 0, 54 г Са2+ и 0,32 г Mg2+. Чему равна общая жесткость воды?
ЖО = 2,69 + 2,63 = 5,32
http://buzani.ru/zadachi/khimiya-glinka/1248-khimicheskie-reaktsii-kompleksnykh-soedinenij-za9-733
http://pandia.ru/text/78/501/46785-6.php