Методы получения. 14.1.1.1. Гидролиз галогенпроизводных аренов
14.1.1.1. Гидролиз галогенпроизводных аренов. Гидролиз самого хлорбензола протекает с большим трудом из-за –I-эффекта атома хлора по механизму «элиминирование – присоединение». Условия гидролиза: 10-15%-ный водный раствор NaOH, 350 0 С, 315 атм., время реакции – 20 мин
Хлорбензолы, содержащие в кольце и другие заместители электроноакцепторного типа, гидролизуются значительно легче по бимолекулярному механизму. Интересно, что в качестве таких облегчающих гидролиз заместителей могут выступать и атомы галогена. На этом основано получение хлорфенолов: 2,4,5-трихлорфенола и пентахлорфенола
С сожалением приходиться отмечать, что процесс гидролиза тетрахлорбензола часто выходит из-под контроля. При этом быстро и самопроизвольно температура реакции повышается со 160 0 С до 230 0 С и выше, происходит соответствующее повышение давления. При таком развитии событий (Севезо, 1976 г.) две молекулы фенолята натрия трихлорфенола вступают между собой в реакцию Вильямсона с образованием 2,3,7,8-тетрахлордибензо-п-диоксина
Диоксин – один из наиболее ядовитых органических соединений, созданных когда-либо руками человека. Среднесмертельная доза для человека, полученная расчетным путем, составляет при однократном оральном поступлении 0,05-0,07 микрограммов (миллионных долей грамма).
14.1.1.2. Щелочной плав солей сульфоновых кислот. Этот метод раньше, до разработки кумольного метода, широко применялся для получения фенола и крезолов. Замещение сульфогруппы на гидроксил осуществляется при нагревании солей сульфоновых кислот с едкими щелочами при 300 0 С и выше
14.1.1.3. Замещение диазогруппы на гидроксил. Эта реакция протекает легко даже в водном растворе соли диазония при 5 – 10 0 С
Гидролиз солей диазония – удобный и универсальный лабораторный метод получения разнообразных фенолов.
14.1.1.4. Кумольный метод. Такое название получил метод синтеза фенола разложением гидроперекисей алкилбензолов, чаще всего кумола (Сергеев, Удрис, Кружалов)
В приведенной схеме ключевым является превращение гидроперекиси кумола в фенол и ацетон.
Предложен следующий механизм кислотного разложения гидроперекиси.
В начальной стадии происходит протонирование гидроксильного кислорода гидроперекиси, который далее отщепляет молекулу воды и превращается в окисный катион
Эта промежуточная частица претерпевает перегруппировку по механизму 1,2-фенильного сдвига. Сам факт этой перегруппировки свидетельствует, что резонансный гибрид канонических структур IV и V устойчивее, чем окисный катион III. Полагают, что движущая сила перегруппировки достаточно велика и, возможно, 2 и 3 стадии рассматриваемого механизма протекают одновременно
Электрофильная частица, представленная формулами IV и V, присоединяет воду и отщепляет протон. В результате получается гемикеталь VII, образованный фенолом и ацетоном
На финальной стадии имеет место гидролиз неустойчивого полукеталя
В настоящее время по кумольному методу получают основное количество фенола.
14.1.1.5. Разные реакции. В основу синтеза сложных фенолов, особенно находящих практическое применение, положены самые обычные реакции алкилирования, галогенирования и конденсации самого фенола.
Ниже приводятся примеры таких специальных синтезов.
Как известно, необходимый для синтеза гербицида 2,4-Д дихлорфенол получают хлорированием фенола
Одним из эффективных антиоксидантов, ингибирующих окисление многих веществ кислородом воздуха, оказались так называемые экранированные фенолы, особенно 4-метил-2,6-ди-трет-бутилфенол (ионол). Его можно получить алкилированием п-крезола изобутиленом
Так же с использованием реакции Фриделя-Крафтса осуществляется синтез алкилфенолов исходя из фенола и тримеров и тетрамеров пропилена и изобутилена
Еще один пример – синтез так называемого бис-фенола, на основе которого производится ценнейший полимер – поликарбонат, относящийся к сложным эфирам угольной кислоты
В бензольное кольцо в фенолах могут быть введены и функциональные группы. Одним из интересных примеров может послужить синтез салициловой кислоты по реакции Кольбе-Шмидта
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Напишите уравнение реакции щелочного гидролиза хлорбензола10.1. Химизм щелочного гидролиза, аминирования и алкилирования. Гидролизом в технологии полупродуктов и красителей называют процесс обмена заместителя, находящегося я ядре или боковой цепи ароматических углеводородов на гидроксильную группу. Гидролизу подвергаются чаще всего хлорпроизводные и амины (хлорбензол, альфанафтиламин). Процесс протекает в растворе щелочей, поэтому и носит название щелочного гидролиза. Суммарное химическое уравнение щелочного гидролиза можно представить следующим образом:
где Х — заместитель, обмениваемый на гидроксильную группу. Аминированием называют процесс обмена заместителей в ароматическом соединении на аминогруппу. Часто аминированию подвергают хлорбензол, бета-нафтол, нафтолсульфокислоты. Аминирующим агентом служат водные растворы аммиака, сульфита аммония и т.д. Уравнение процесса аминирования имеет вид:
где Х- заместитель, обмениваемый на аминогруппу ( OH , CL , SO 3 H ). Алкилированием называют процессы замещения атомов водорода в молекулах органических соединений алкильными радикалами. В качестве алкилирующих агентов используют метиловый, этиловый и другие спирты, галоидалкилы. Например, алкилирование аминосоединений происходит по следующей реакции: источники: http://acetyl.ru/o/z61b1h22f6b.php http://www.gaps.tstu.ru/win-1251/lab/sreda/gapsht/6/hgid.html |
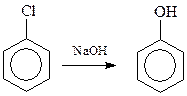
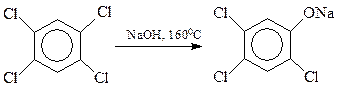
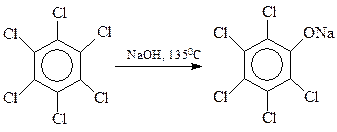
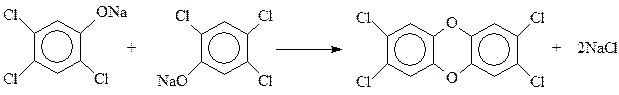
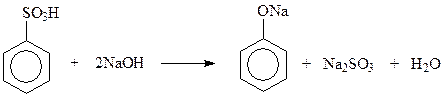
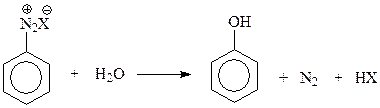
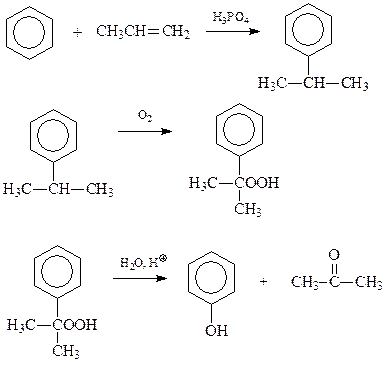
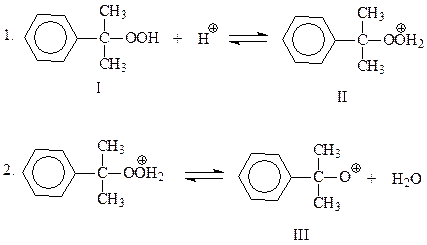
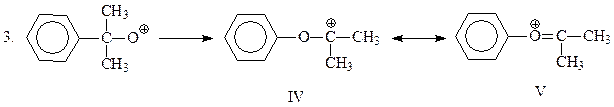
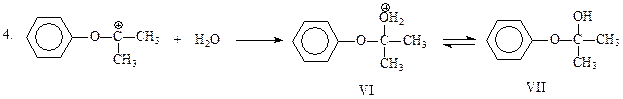
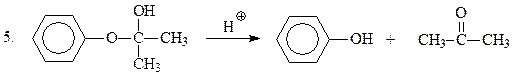
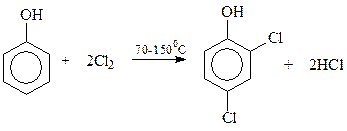
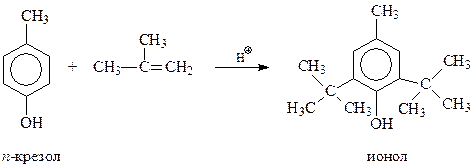
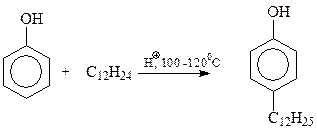
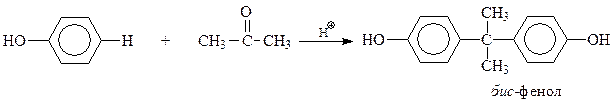

 ,
, ,
,