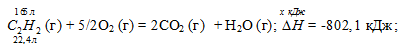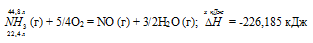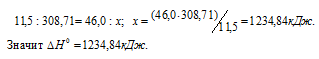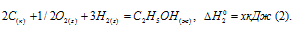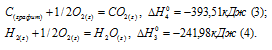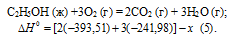Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
Образцы выполнения с/р2
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. РАВНОВЕСИЕ. КИНЕТИКА.
ЗАДАЧА 1. Теплота сгорания топлива.
| Объем топлива, л | Состав топливной смеси, % | |||
| СН4 | С2Н6 | С3Н8 | С4Н10 | С6Н6 |
| — | — | — |
Имеем газовую топливную смесь: 50%СН4 + 50%С4Н10.
Суммарный объем V=1000 л=1м 3 .
Напишите химические уравнения реакций горения газовых составляющих заданной топливной смеси.
Реакция горения метана:
Реакция горения бутана:
Энтальпия Δ r Н 0 298 этих химических реакций является теплотой сгорания газового топлива ΔН 0 сг.
2. Рассчитайте, сколько теплоты можно получить при сжигании заданного объема топливной смеси заданного состава (объемные %), условия считать нормальными.
С использованием закона Гесса рассчитаем теплоту сгорания газового топлива ΔН 0 сг при стандартном состоянии и 298 К, используя табличные данные (см. приложение, табл. ) теплоты образования всех веществ, участвующих в реакции горения (Δf Н 0 298):
= — 393,62 + 2 . (-285,84) – (-74,78) — 0 = -802,28 кДж/моль.
= 4 . (- 393,62) + 5 . (-285,84) – (-126,15) — 0 = -2877,53 кДж/моль.
Удельная теплота сгорания QТ газового топлива:
где 22,4 л/моль – молярный объем газа при н.у.
QT, СН4= — ( -802,28 . 1000 / 22,4) =35816 кДж/м 3 .
QT, С4Н10= — ( -2877,53 . 1000 / 22,4) =128461 кДж/м 3 .
Суммарное количество теплоты, полученное при сгорании данной топливной смеси с учетом объемов газов:
=35816 . (1 . 0,5)+128461 . (1 . 0,5) =82138,5 кДж.
3. Из заданной топливной смеси выберите наиболее энергоэффективное топливо. Рассчитайте удельную теплоту сгорания этого топлива QT, кДж/м 3 . Рассчитайте минимальный объем этого топлива для получения 100 МДж теплоты.
Наиболее энергоэффективное топливо в данной топливной смеси – бутан, удельная теплота сгорания QT, С4Н10 = 128461 кДж/м 3 .
Для получения 100 МДж теплоты необходимо сжечь:
VС4Н10 = Q/ QT, С4Н10 =100000/128461=0,778 м 3 = 778 л.
ЗАДАЧА 2. Химическая термодинамика.
| Химическая реакция (п.1) | ргаз . 10 -5 , Па (п.2) | Сисх, моль/л (п.3) | |||
| А | В | D | М | А | В |
| СO2 (г) + C(к) « 2CО(г) | — | 0,02 | — | 0,5 | — |
Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
Для химической реакции
Вещество C(к) – простое, устойчивое при 298 К и давлении 100 кПа, энтальпия его образования DH 0 f,298, = 0.
Термохимические уравнения реакций, тепловой эффект которых является теплотой образования реагентов заданной химической реакции СO2 (г) и CО(г) :
2. Рассчитайте величины энтальпии Dr H 0 298 , энтропии Dr S 0 298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Сделайте вывод о тепловом эффекте реакции.
По табличным данным (см. табл. ) запишем термодинамические функции состояния реагентов заданной химической реакции при стандартном состоянии и 298 К
| вещество | DH 0 f,298, кДж/моль | DG 0 f,298 , кДж/моль | S 0 f,298 , Дж/моль . К | ср, Дж/моль . К | Температурный интервал, К |
| С(графит) | 5,74 | 8,54 | 298-2300 | ||
| СО2 (г) | -393,51 | -394,38 | 213,68 | 37,41 | 298-2500 |
| СО (г) | -110,5 | -137,14 | 197,54 | 29,14 | 298-2500 |
С использованием закона Гесса рассчитаем энтальпию ΔrН 0 298, энтропию ∆rS 0 298и энергию Гиббса Δr G 0 298 химической реакции при стандартном состоянии и 298 К:
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
Δr Н 0 298 >0 — реакция эндотермическая, идет с поглощением теплоты.
= 175,66 Дж/К.
∆rS 0 298>0 – система стала более неупорядоченной вследствие образования дополнительного количества газа.
3. Рассчитайте величину энергии Гиббса DrG 0 298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Определите, в каком направлении будет самопроизвольно протекать данная реакция при стандартном состоянии всех реагентов и температуре 298 К.
= 2(-137,14) – 0 – (-394,38) = 120,15 кДж.
ΔrG 0 298 >0 – самопроизвольное протекание реакции в прямом направлении при стандартном состоянии и 298 К невозможно. Реакция протекает в обратном направлении.
4. Определите область температур, при которых возможно самопроизвольное протекание прямой реакции при стандартном состоянии всех реагентов без учета зависимости Dr H 0 и Dr S 0 от температуры. Постройте график зависимости энергии Гиббса реакции от температуры DrG 0 = f (Т ).
Возможность самопроизвольного протекания реакции при стандартном состоянии определяется неравенством ∆r G 0 T 0 T = ∆r H 0 298 + 
298 982 2300Т
С учетом температурных интервалов существования реагентов температурная область самопроизвольного протекания реакции при стандартном состоянии 982 0 Т + RTln 
Рассчитаем Δr G298 при 298 К и давлениях газов: рСО = 2 . 10 3 Па,
Относительные парциальные давления газов:

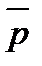
ΔrG298 >0 – самопроизвольное протекание реакции в прямом направлении при заданных парциальных давлениях газов и 298 К невозможно. Реакция протекает в обратном направлении.
6. Определите, как нужно (теоретически) изменить парциальное давление любого из исходных газов (рА или рВ) для изменения направления протекания процесса по сравнению со стандартным состоянием при 298 К и стандартном парциальном давлении всех других компонентов химической реакции.
При стандартном состоянии и 298 К возможно самопроизвольное протекание реакции в обратном направлении, т.к. ΔrG 0 298 >0.
Для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К можно изменить парциальное давление СО2 , (состояние всех других компонентов стандартное). Условием самопроизвольного протекания реакции в прямом направлении является ΔrG298 0 Т + RTln 

Таким образом, для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К и давлении рСО = 10 5 Па нужно увеличить парциальное давление СО2 в 10 5 раз, т.е. парциальное давление СО2 должно быть: рСО2 > 10 25 Па.
При таком давлении СО2 заданная химическая реакция может самопроизвольно протекать в прямом направлении при 298 К.
Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
http://poisk-ru.ru/s18037t18.html
http://chemege.ru/termochemistry/