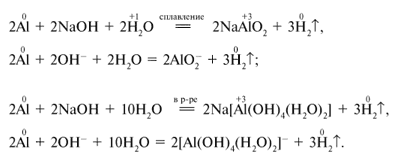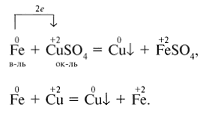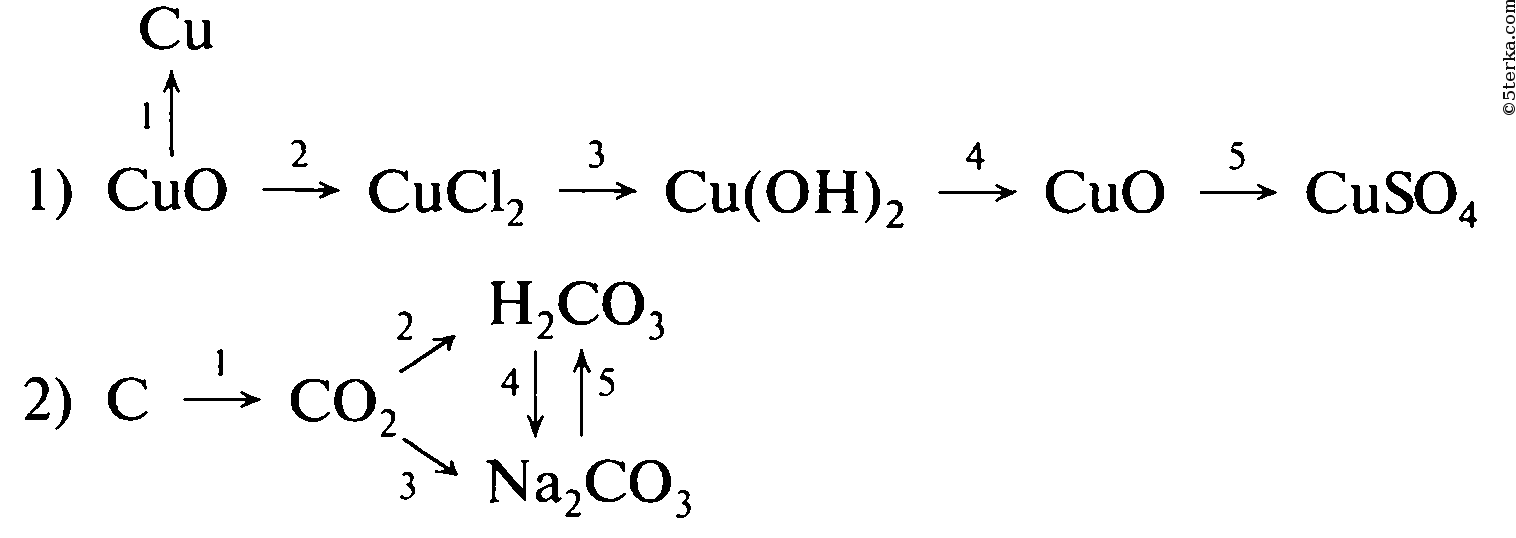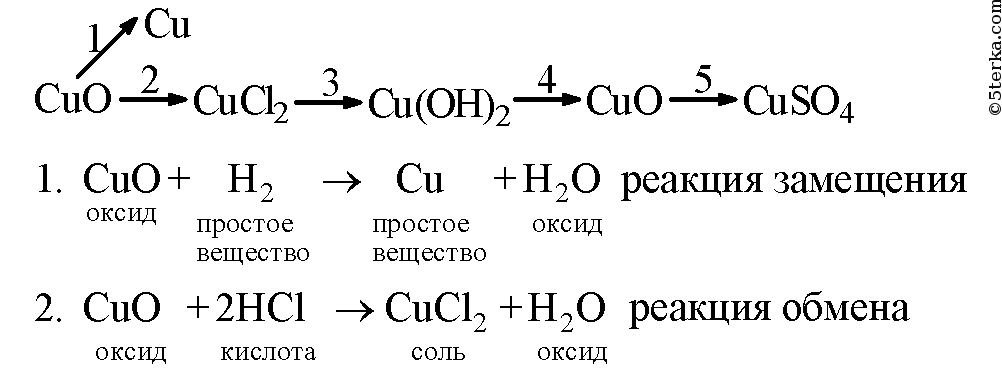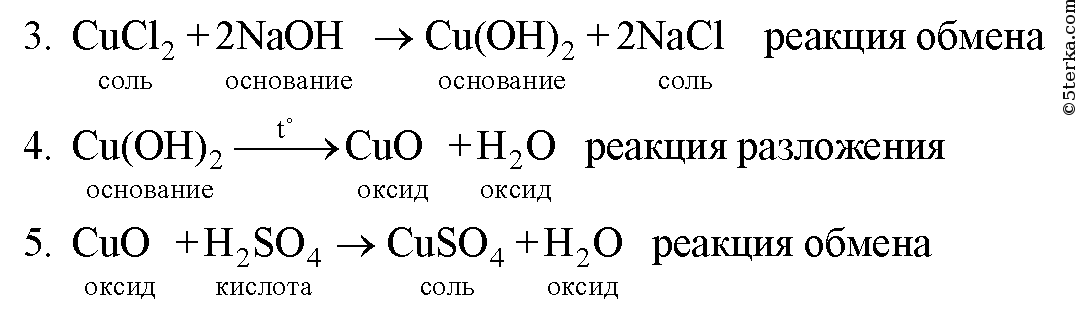Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
— строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
— понятие металлической связи; типы кристаллических решеток разных металлов;
— зависимость физических свойств металлов от их строения;
— распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
— характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
— устанавливать связь между строением веществ и их свойствами.
Просмотр содержимого документа
«Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей»
Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
— строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
— понятие металлической связи; типы кристаллических решеток разных металлов;
— зависимость физических свойств металлов от их строения;
— распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
— характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
— устанавливать связь между строением веществ и их свойствами.
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Периодическая система химических элементов им. Д.И. Менделеева;
Ряд стандартных электродных потенциалов Е 0 ;
Типы кристаллических решеток металлов.
Ряд напряженности металлов.
Тетрадь для практических и контрольных работ.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м 3 ) и тяжелые (от 6000 кг/м 3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е 0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
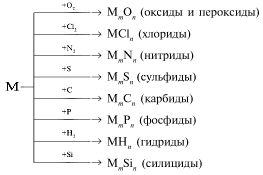
Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
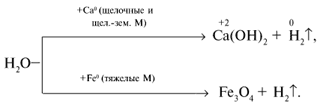
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Вопросы для закрепления теоретического материала к практическому занятию
Перечислить общие физические свойства металлов.
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Напишите уравнение реакции взаимодействия металла с кислотой
алюминий + серная кислота
железо + соляная кислота
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
В результате реакции выделяется газ (H2) водород.
Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла
алюминий + железный купорос
железо + медный купорос
Образец решения задания № 2
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
В результате реакции выделяется металлическая медь (красный осадок).
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
Магний оксид магния хлорид магния гидроксид магния сульфат магния
Медь оксид меди сульфат меди гидроксид меди оксид меди
Образец решения задания № 3
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
Вопросы для контроля
Перечислите основные химические свойства металлов?
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e245e5b693c16fe • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Напишите уравнение реакции замещения алюминий железный купорос
Составьте уравнения реакции и укажите их тип. Расставьте коэффициенты там, где это необходимо.
1. водород + хлор = хлорид водорода
2. серная кислота + алюминий = сульфат алюминия + водород
3. гидроксид калия + серная кислота = сульфат калия + вода
4. хлорид кальция + нитрат серебра =нитрат кальция + хлорид серебра
В.5
Составьте уравнения реакции и укажите их тип. Расставьте коэффициенты там, где это необходимо.
1. кослород+ фосфор = оксид фосфора (V)
2. серная кислота + кобальт = сульфат кобальта + водород
3. гидроксид кальция + серная кислота = сульфат кальция + вода
4. хлорид железа(II) + нитрат серебра = нитрат железа(II) +хлорид серебра
В.8
Составьте уравнения реакции и укажите их тип. Расставьте коэффициенты там, где это необходимо.
1. алюминий + кислород = оксид алюминия
2. соляная кислота + железо(II) = хлорид железа(II) + водород
3. гидроксид лития + соляная кислота = хлорид лития + вода
4. сульфат железа(II) + + хлорид бария = хлорид железа(II) + сульфат бария
В.11
Составьте уравнения реакции и укажите их тип. Расставьте коэффициенты там, где это необходимо.
1. кальций + хлор = хлорид кальция
2. соляная кислота + кобальт = хлорид кобальта + водород
3. гидроксид натрия + азотная кислота = нитрат натрия + вода
4. хлорид натрия + нитрат серебра = нитрат натрия + хлорид серебра
http://gomolog.ru/reshebniki/8-klass/zadachnik-kuznecova-2020/5-126.html
http://znanija.org/himiya/35305645.html