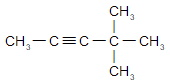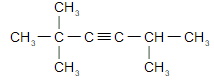Напишите уравнение реакций и назовите по международной номенклатуре
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие углеводороды называют алкинами? Алкинами называют углеводороды с общей формулой CnH2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С.
Приведите названия, молекулярные и структурные формулы первых четырёх представителей гомологического ряда алкинов.
| Название | Молекулярная формула | Структурная формула |
| этин | C2H 2 | HC≡CH |
| пропин | C3H 4 | HC≡C ― CH 3 |
| бутин-1 | C4H 6 | HC≡C ― CH2 ― CH 3 |
| пентин-1 | C5H 8 | H3C ― C≡C ― CH2 ― CH 3 |
Задание 2
Сравните общие формулы диеновых и ацетиленовых углеводородов. Общие формулы CnH2n-2 одинаковые.
Можно ли однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6? Нельзя, т.к. молекулярная формула не отражает пространственное строение молекулы. Например, формуле C4H6 могут соответствовать алкин и алкадиен.
Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав, и назовите их.
| Структурная формула алкадиена C4H6: | Структурная формула алкина C4H6: |
| CH2=CH―CH=CH2 бутадиен-1,3 | H3C ― C≡C ― CH 3 бутин-2 |
Какой вид изомерии характерен для этих соединений? Для алкадиенов и алкинов характерны следующие виды изомерии:
― углеродного скелета;
― положение связи (двойной или тройной) ;
― межклассовая изомерия; цис-транс-изомерия.
Задание 3
Назовите по международной номенклатуре следующие углеводороды:
а) 4-метилпентин-2 (опечатка в задании)
б) пентин-1
в) 3,3-диметилбутин-1
Задание 4
Напишите структурные формулы следующих алкинов:
а) бутин-1;
HC≡C ― CH2 ― CH 3
б) пентин-2;
CH3 ― C≡C ― CH2 ― CH 3
в) 4,4-диметилпентин-2;
г) 2,2,5-триметилгексин-3.
Завдання 5
Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить? Ответ проиллюстрируйте уравнениями химических реакций.
Этилен и ацетилен сгорают в кислороде:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
2HC≡CH + 5O2 ⟶ 4CO2 + 2H2O
В реакции гидратации этилена образуется спирт, а ацетилена – альдегид:
CH2=CH2 + H2O кат. ⟶ CH3 ― CH2 ― OH
HC≡CH + H2O кат. ⟶ CH3 ― CHO
Этилен и ацетилен вступают в реакцию гидрогалогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + HBr ⟶ CH3 ― CH2Br
HC≡CH + HBr ⟶ CH2=CHBr
CH2=CHBr + HBr ⟶ CH3 ― CHBr2
Этилен и ацетилен вступают в реакцию галогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + Br2 ⟶ CH2Br ― CH2Br
Задание 7
На технический карбид кальция массой 40 г подействовали избытком воды. При этом образовалось 11,2 л газа (н.у.). Определите массовую долю примесей в карбиде кальция.
Дано: m(CaC2 c прим.)=40 г, V(C2H2)=11,2 л
Найти: ω(примеси)-?
Решение
1-й способ
1. Количество вещества этина рассчитываем по формуле: ʋ=V/Vm, где Vm― молярный объём.
ʋ(C2H2)=V( C2H2 )/Vm=11,2 л : 22,4 л/моль=0,5 моль
2. Составляем химическое уравнение: CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
По уравнению реакции ʋ(CaC2): ʋ(C2H2)=1:1 , количества вещества одинаковые, поэтому :
ʋ(CaC2)=ʋ( C2H2 )=0,5 моль
3. Массу технического карбита кальция рассчитываем по формуле: m=ʋ•M, где M ― молярная масса.
M(CaC2)=64 г/моль
m( CaC2 )= ʋ(CaC2) • M( CaC2 )=0,5 моль • 64 г/моль=32 г
4. Рассчитываем массу примесей в техническом карбиде кальция.
m(примесей)=m(CaC2 c прим.)-m(CaC2)=40 г — 32 г=8 г
5. Рассчитываем массовую долю примесей в техническом карбиде кальция:
ω(примеси)=(m(примеси)/ m(CaC2 c прим.)) • 100% =8 г : 40 г • 100%=20%
2-й способ
1. Составляем химическое уравнение:
х г 11,2 л
CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
64 г 22,4 л
Над формулами соединений CaC2 и C2H2 записываем неизвестную массу технического карбида кальция (х г) и приведенный в условии задачи объём этина (11,2 л), а под формулами соединений ― массу и объём количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
M(CaC2)=64 г/моль, поэтому масса 1 моль=64 г
х= m( CaC2)=64 г • 11,2 л : 22,4 л=32 г
2. Рассчитываем массовую долю технического карбида кальция:
ω( CaC2 )=(m( CaC2 )/ m(CaC2 c прим.)) • 100% =32 г : 40 г • 100%=80%
3. Рассчитываем массовую долю примесей в техническом карбиде кальция.
ω (примеси)= ω (CaC2 c прим.)- ω (CaC2)=100% — 80%=20%
Ответ: ω(примеси)=20%
Задание 8
Термохимическое уравнение реакции горения ацетилена имеет вид 2C2H2 + 5O2 ⟶ 4CO2 + 2H2O + 2600 кДж Рассчитайте количество теплоты, которое выделится при сгорании 44,8 л ацетилена (н.у.).
По термохимическому уравнению реакции с 44,8 л (2 моль) С2H2 выделяется 2600 кДж теплоты,
по условию задачи с 44,8 л С2H2 ― х кДж теплоты.
х = 22,4 л ● 2600 кДж : 22,4 л=2600 кДж
Ответ: 2600 кДж
Определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре (табл.1). Номер варианта Реакции 2 SeO3 + MgO → CsOH + CaO → FeSO4 + LiOH → BaHPO






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре (табл.1).
Номер варианта
Реакции
2
SeO3 + MgO →
CsOH + CaO →
FeSO4 + LiOH →
As + Ba →BaAs
Решение :
SeO 3(оксид селена VI ) + MgO (оксид магния) → MgSeO 4(селенат магния)
CsOH (гидроксид цезия) + CaO (оксид кальция) ≠
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Поставить индексы в формулах химических соединений (табл.3). Назвать соединения по международной номенклатуре. Написать уравнения реакций получения соединений. 2 CaPO4, LiHBO3, ZnOHCrO4
- Написать формулы оксидов, соответствующих указанным гидроксидам (табл.4). Написать уравнения реакций, доказывающих основной, кислотный или амфотерный характер оксидов и их гидроксидов 2 H2SiO3, Pb(OH)
- Рассчитать массу умягчителя, необходимого для умягчения х л воды, жесткость которой у. Вычислить жесткость зная массу умягчителя. Написать реакцию умягчения. № 242
- Составить уравнения реакций взаимодействия натрия с аммиаком, водородом, хлором, водой. Какое свойство проявляет натрий во всех этих реакциях?
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
домашнее задание. Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре
| Название | Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре |
| Анкор | домашнее задание.doc |
| Дата | 29.03.2018 |
| Размер | 387 Kb. |
| Формат файла |  |
| Имя файла | домашнее задание.doc |
| Тип | Документы #17346 |
| страница | 17 из 17 |
| Подборка по базе: Попов А.И.,Человек на Луне. Какие доказательства.doc, Практическая работа Равновесие и скорость химической реакции 2.d, пример решения задачи реакции опоры.docx, _Скорость химической реакции, равновесие.pptx, Серологические реакции.doc, Экстренная психологическая помощь при острой реакции на стресс.d, Определение константы скорости химической реакции.doc, Что такое Жизненный Цикл Разработки ПО и какие проблемы возникаю, 25_П_В1_Химия 8_Экзотермические и эндотермические реакции. Лабор, 140 проблемных реакций неорганики.pdf 4. Вычислите константу равновесия химической реакции и определите начальные концентрации вступивших в реакцию веществ, если равновесные концентрации: [H2]=0,02 моль/л; [I2]=0,04 моль/л; [HI]=0,09 моль/л. 5. Куда сместится равновесие химической реакции при увеличении температуры и уменьшении давления? Вещество | MgО(k) | CO2(г) |
| Н 0 298, кДж/моль | -602,1 | -393,8 |
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
7.Составьте схему гальванического элемента, в котором протекает приведенная ниже токообразующая реакция. Вычислите ЭДС элемента. Чему равно ΔG 0 Х.Р.?
Cd + SnCl 2 ( c =0,1моль/л) → CdCl 2 ( c =0,01моль/л) + Sn
8. Вычислите объем H2 при нормальных условиях (н.у.), который выделяется при электролизе КCl, если сила тока 5А, время электролиза 20 минут.
9.Технический магний подвергается коррозии в растворе хлорида натрия при контакте раствора с воздухом. Напишите уравнение реакции анодного и катодного процесса. Составьте схему образующихся микрогальванопар.
10.Напишите электронные формулы частиц: O 2- , Ne, F — , N 3- . Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
ВАРИАНТ 28.
- Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
CaO + H2CrO4 → V2O5 + KOH →
(ZnOH)2CO3 + H2SO4 → Pb + H2S →
- Сколько миллилитров 18% раствора AgNO3 (ρ=1,171 г/см 3 ) нужно взять, чтобы приготовить 0,1л 2,0Н раствора?
- Используя термодинамические величины веществ, вычислить для химической реакции изменения энтальпии, энтропии и энергии Гиббса. Определите, в каком направлении возможно протекание реакции.
CaSO4(к) + CО2(г) → СаСО3(к) + SO3(г)
| Вещество | Н 0 298, кДж/моль | S 0 298, Дж/моль . К |
| CaSO4(к) | -1435,1 | 106,8 |
| CО2(г) | -393,8 | 213,8 |
| СаСО3(к) | -1207,7 | 92,9 |
| SO3(г) | -396,1 | 256,8 |
4. Вычислите константу равновесия химической реакции и определите начальные концентрации вступивших в реакцию веществ, если равновесные концентрации: [N2]=3 моль/л; [H2]=2 моль/л; [NH3]=4 моль/л.
5. Куда сместится равновесие химической реакции при увеличении температуры и уменьшении давления? S(poмб.) + 2H2O(ж) SО2(r) +2H2(г)
| Вещество | H2O(ж) | SO2(г) |
| Н 0 298, кДж/моль | -286,0 | -297,1 |
6. Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
7. Составьте схему гальванического элемента, в котором протекает приведенная ниже токообразующая реакция. Вычислите ЭДС элемента. Чему равно ΔG 0 Х.Р.?
Zn + Cu +2 ( c =1моль/л) → Zn +2 ( c =0,01моль/л) + Cu
8. Вычислите объем кислорода при нормальных условиях (н.у.), который выделяется при электролизе КОН, если сила тока 10А, время электролиза 30 минут.
9.Техническая медь подвергается коррозии в растворе хлорида натрия при контакте раствора с воздухом. Напишите уравнение реакции анодного и катодного процесса. Составьте схему образующихся микрогальванопар.
10.Напишите электронные формулы частиц: Ge, Se 2- , Kr, Br — . Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
ВАРИАНТ 29.
- Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SnO + HCl → N2O5 + LiOH →
MgOHNO3 + HNO3 → Al + PtCl2 →
- Сколько миллилитров 10% раствора AlCl3 (ρ=1,090 г/см 3 ) нужно взять, чтобы приготовить 0,2л 0,1M раствора?
- Используя термодинамические величины веществ, вычислить для химической реакции изменения энтальпии, энтропии и энергии Гиббса. Определите, в каком направлении возможно протекание реакции.
4HCl(r) + О2(r) → 2Cl2(r) + 2Н2O(ж)
| Вещество | Н 0 298, кДж/моль | S 0 298, Дж/моль . К |
| HCl(r) | -92,36 | 186,92 |
| О2(r) | 0 | 205 |
| Cl2(r) | 0 | 222,9 |
| Н2O(ж) | -286,0 | 70,0 |
4. Вычислите константу равновесия химической реакции и определите начальные концентрации вступивших в реакцию веществ, если равновесные концентрации: [H2]=0,4 моль/л; [O2]=0,1 моль/л; [H2O]=0,5 моль/л.
5. Куда сместится равновесие химической реакции при увеличении температуры и уменьшении давления?
S(ромб.) + 2CO2(г) SО2(r) +2CO(г)
| Вещество | S(ромб.) | SО2(r) | СО(г) | CO2(г) |
| Н 0 298, кДж/моль | 0 | -297,1 | -110,6 | -393,8 |
6. Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
7. Составьте схему гальванического элемента, в котором протекает приведенная ниже токообразующая реакция. Вычислите ЭДС элемента. Чему равно ΔG 0 Х.Р.?
3 Zn + 2 Cr +3 ( c =0,001моль/л) → 3 Zn +2 ( c =0,1моль/л) +2 Cr
8. Вычислите хлора при нормальных условиях (н.у.), который выделяется при электролизе SnCl2, если сила тока 5А, время электролиза 5 минут.
9.Технический никель подвергается коррозии в растворе хлорида натрия при контакте раствора с воздухом. Напишите уравнение реакции анодного и катодного процесса. Составьте схему образующихся микрогальванопар.
10.Напишите электронные формулы частиц: S 2- , Ar, P 3- , Cl — . Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
ВАРИАНТ 30.
- Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
BaO + TiO2 → Al2O3 + NaOH →
CuOHNO3 + HNO3 → CuO + H2 →
- Сколько миллилитров 16% раствора BaCl2 (ρ=1,156 г/см 3 ) нужно взять, чтобы приготовить 0,25л 0,01Н раствора?
- Используя термодинамические величины веществ, вычислить для химической реакции изменения энтальпии, энтропии и энергии Гиббса. Определите, в каком направлении возможно протекание реакции.
СаСО3(к) + 4С(гр) → СаС2(к) + 3СО(г)
| Вещество | Н 0 298, кДж/моль | S 0 298, Дж/моль . К |
| СаСО3(к) | -1207,7 | 92,9 |
| С(гр) | 0 | 5,7 |
| СаС2(к) | -59,9 | 70,0 |
| СО(г) | -110,6 | 197,6 |
4. Вычислите константу равновесия химической реакции и определите начальные концентрации вступивших в реакцию веществ, если равновесные концентрации: [CO]=0,05 моль/л; [O2]=0,05 моль/л; [CO2]=0,4 моль/л.
5. Куда сместится равновесие химической реакции при увеличении температуры и уменьшении давления? 2CO(r) + SO2(г) S(ромб.) +2CO2(г)
| Вещество | SО2(r) | СО(г) | CO2(г) |
| Н 0 298, кДж/моль | -297,1 | -110,6 | -393,8 |
6. Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
7. Составьте схему гальванического элемента, в котором протекает приведенная ниже токообразующая реакция. Вычислите ЭДС элемента. Чему равно ΔG 0 Х.Р.?
Cd + H 2 SO 4 ( c =1моль/л) → CdSO 4 ( c =0,01моль/л) + H 2
8. Вычислите объем водорода при нормальных условиях (н.у.), который выделяется при электролизе Na2SO4, если сила тока 3А, время электролиза 20 минут.
9.Техническое олово подвергается коррозии в растворе хлорида натрия при контакте раствора с воздухом. Напишите уравнение реакции анодного и катодного процесса. Составьте схему образующихся микрогальванопар.
10.Напишите электронные формулы частиц: He, Li + , Be 2+ , N 3- . Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
http://natalibrilenova.ru/opredelit-kakie-reaktsii-budut-protekat-napisat-ih-uravneniya-i-nazvat-vse-veschestva-po-mezhdunarodnoj-nomenklature-tabl1-nomer-varianta-reaktsii-2-seo3—mgo—csoh—cao—feso4—lioh—bahpo/
http://topuch.ru/opredelite-kakie-reakcii-budut-protekate-napishite-ih-uravneni/index17.html