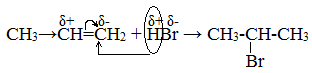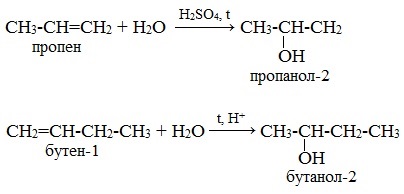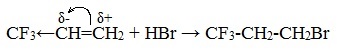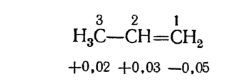Напишите уравнение сформулируйте правило марковникова
Правило Марковникова — при присоединении галогеноводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) углеродному атому (т.е. к атому С, связанному с большим числом атомов Н), а атом галогена (или группа –ОН) – к наименее гидрогенизированному.
Правило, устанавливающее направление реакции присоединения галогеноводородов (гидрогалогенирование) и воды (гидратация), сформулировал русский химик В.В. Марковников в 1869 г.
Правило Марковникова о присоединении по двойной связи объясняется смещением электронной плотности в молекулах несимметричных алкенов.
Механизм присоединения по правилу Марковникова
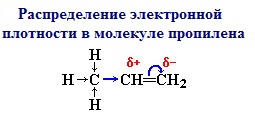
Электронная плотность в молекуле СН3-СН=СН2 до вступления в реакцию распределена неравномерно. Это обусловлено тем, что метильная группа СН3 за счет суммирования небольшой полярности трех С-Н-связей является донором электронов, т.е. проявляет +I-эффект ссылка по отношению к соседним атомам углерода.
Это вызывает смещение подвижности π-электронов двойной связи в сторону более гидрогенизированного атома углерода и появлению на нем частичного отрицательного заряда (δ-).
На другом, менее гидрогенизированном, атоме углерода возникает частичный положительный заряд (δ+). Поэтому атака электрофильной частицы Н+ происходит по более гидрогенизированному углеродному атому, а атом галогена или группа –ОН присоединяются к менее гидрогенизированному атому углерода.
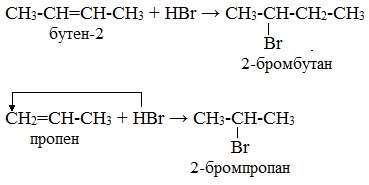
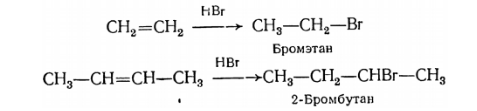
Например, гидробромирование бутена-2 и пропена:
Бутен-2 является симметричным алкеном, оба углеродных атома относительно двойной связи совершенно равноценны. В результате первой реакции образуется один продукт – 2-бромбутан.
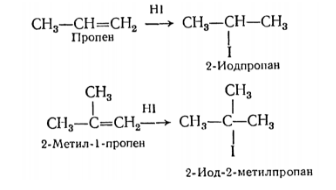
Пропен – несимметричный алкен. Один углеродный атом при двойной связи более гидрогенизирован, т.е. содержит большее число атомов водорода. Поэтому продуктом реакции является 2-бромпропан.
Присоединение воды к несимметричным алкенам также происходит по правилу Марковникова.
Например, гидратация пропена и бутена-1:
В результате гидратации пропена образуется пропанол-2, а не пропанол-1. А в результате гидратации бутена-1 – бутанол-2, а не бутанол-1.
Если же в алкене присутствует электроноакцепторный заместитель, т.е. группа, обладающая способностью оттягивать на себя электронную плотность, более стабильным может оказаться первичный катион и реакция пойдет против правила Марковникова, например гидрогалогенирование трифторпропена.
Правило Марковникова — формулировка и примеры использования в химии
Правило Марковникова в химии имеет большое значение в случаях взаимодействия воды или протонных кислот с такими органическими веществами как алкены и алкины. Примером может служить уравнение реакции: пропен + вода.
Суть этого правила в направлении разных типов реакций в зависимости от химического строения с участием реагентов, в структуре которых есть двойная связь. За этим правилом могут протекать реакции присоединения, отщепления, замещения, а также — реакции изомеризации.
Кратко о жизни и деятельности ученого-органика Марковникова
Ученый Владимир Васильевич Марковников занимался исследованиями в таких отраслях как органический синтез, нефтехимия и теоретическая органическая химия.
Марковников Владимир Васильевич (1838-1904)
В период с 1862 по 1867 гг. он смог пополнить багаж знаний человечества об изомерах спиртов и жирных кислот, открыть в ряду олефиновых углеродов оксиды, в первый раз в истории синтезировать оксо- и галогенопроизводные изомеры масляной кислоты.
На основании знаний, полученных в результате этих исследований, учёный смог сформулировать новое учение про взаимное влияние атомов, которое впоследствии получило имя автора. Сделал он это в 1869 г.
Современная формулировка правила Марковникова
Механизм реакции взаимодействия электрофильных реагентов с молекулами органических веществ, в которых есть двойная связь (электрофильное присоединение), происходит с образованием наиболее устойчивых карбокатионов.
Но если в строении алкена есть неконцевая двойная связь, то в этом случае будет иметь место правило Зайцева.
В соответствии с ним — тогда будет менее выражена ориентация присоединения.
Механизм электрофильного присоединения
Направление реакций этого типа происходит благодаря такому явлению как электронный эффект. То есть, благодаря смещению электронной плотности в молекуле.
На первой стадии образуется комплекс в результате взаимодействия электронов двойной связи с электрофильной частицей (чаще всего это ион водорода).
Вторая стадия — стадия гетеролитического разрыва связи — характеризуется образованием ковалентной связи между одним из атомов углерода и электрофильной частицей, в итоге образуется карбокатион.
На третьей стадии происходит образование второй связи за счёт второй электронной пары аниона (карбокатион реагирует с анионом).
Простыми словами, общая схема действия этого правила заключается в том, что присоединение иона водорода происходит к тому атому углерода (он обязательно должен находится возле двойной связи), который заряжен более отрицательно.
Исключение из правила
Вопреки правилу протекают реакции, в которых заместителем, стоящим при двойной связи, производится оттягивание электронной плотности в свою сторону. Этим осуществляется проявление электроноакцепторных свойств.
Пример такой реакции есть взаимодействие хлороводорода с 3,3,3-трихлорпропеном.
Вторым случаем, когда реакция присоединения происходит против этого правила, есть протекание реакций за радикальным механизмом (в реакции присутствуют атакующие свободные радикалы).
Примером может служить присоединение олефинов к бромоводороду. В таких реакциях происходит гомолитический разрыв связи.
Где применяется правило Марковникова
Правило нашло своё применение:
В производстве различных смесей, использующихся как на производствах, так и в быту. Например, оно применяется в изготовлении химического сырья, топлива и каучука.
Также его применяют для упрощения производства масел для смазки, спирта и полимеров.
Кроме всего вышеперечисленного, правило используется для изготовления смесей, входящих в состав горючего для бензинных двигателей самолетов и автомобилей, и для производства сажи, из которой потом делается топографическая краска.
Ориентация. Правило Марковникова
Вы будете перенаправлены на Автор24
Значительный интерес для синтеза галогеноалканов и изучения механизма реакции присоединения представляет взаимодействие алкенов с галогеноводородами. В отличие от симметричных электрофилов, галогеноводороды представляют собой несимметричные электрофильные реагенты. Присоединение любого несимметричного электрофила к несимметричному алкену, в принципе, могло бы дать смесь альтернативных продуктов, однако на практике обычно образуется лишь один из них. При гидрогалогенировании этилена и его гомологов, содержащих одинаковые заместители у атомов углерода, связанных двойной связью, получается лишь один продукт присоединения:
Присоединение галогеноводородных кислот к алкенам несимметричного строения могло бы приводить к двум различным продуктам. Однако реакция протекает преимущественно в одном направлении и так, что галоген присоединяется к менее, а водород к более богатому водородом углероду при двойной связи. Другими словами сформулированное в 1870 г. В. В. Марковниковым эмпирическое правило гласит, что несимметричные алкены присоединяют $HX$ таким путем, что преимущественно образуется продукт, в котором $H$ присоединяется к наименее замещенному, а $X$ – к наиболее замещенному концу двойной связи.
Эта закономерность была обнаружена Владимиром Васильевичем Марковниковым (1838—1904 гг., ученик А. М. Бутлерова) и носит название правила Марковникова.
Готовые работы на аналогичную тему
Объяснение правила Марковникова
Механизм реакции следующий: в несимметричных алкенах, например пропилене, двойная $C = C$ -связь частично поляризована. Повышенная электронная плотность возникает у атома углерода, удаленного от метильной группы, а пониженная — у углерода, связанного с ней. Рассматриваемое явление обусловлено некоторой поляризацией связей $H—C$ в метильной группе вследствие большей электроотрицательности углерода (соответственно 2,5 и 2,1 в условных единицах). Это приводит к смещению электронных плотностей от группы $CH_3$ к двойной связи. Подобное смещение электронной плотности может быть обозначено прямой стрелкой, направленной от метильной группы к атому углерода и двойной связи, или изогнутой стрелкой, охватывающей три $H—C$-связи. Этот эффект можно объяснить и большей электроотрицательно- стью атома углерода при двойной связи, находящегося в состоянии $sp2$-гибридизации (2,62), чем электроотрицательность $sp3$-гибридизованного углерода метильной группы (2,5). Отсюда следует, что метильная группа является слабым электронодонорным заместителем. Сказанное подтверждается дипольным моментом пропилена (0,35D).
Обычно правило Марковникова объясняют различием в стабильности двух альтернативных карбокатионов. Например, в приведенном выше примере нормальный пропильный катион значительно менее стабилен, чем изопропильный катион, и поэтому реакция идет по второму пути. В действительности мы, конечно, должны рассматривать относительную стабильность альтернативных переходных состояний стадии образования возможных продуктов. Однако, согласно постулату Хэммонда, распределение заряды в переходном состоянии не сильно отличается от распределения заряда в карбокатионе и поэтому объяснение правила Марковникова через относительную стабильность карбокатионов вполне приемлемо.
Применение расчетных квантовомеханических методов показало, что в пропилене на крайнем атоме углерода при двойной связи содержится повышенная электронная плотность, а на атомах $C_2$ и $C_3$ она понижена (в единицах заряда электрона):
В ходе реакции гидрогалогенирования протон атакует атом уг-лерода с повышенной электронной плотностью. Образуется карбо- катион, который стабилизируется присоединением аниона галогена в 2-галогенопропан. Следовательно, реакция гидрогалогенирования протекает по механизму электрофильного присоединения:
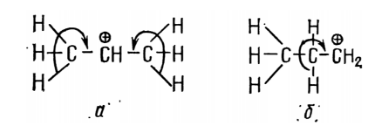
Допустим обратный порядок присоединения галогеноводорода, при котором промежуточным продуктом явится карбокатион с положительным зарядом на крайнем атоме углерода:
Таким образом, задача сводится к сравнению устойчивости обоих карбокатионов:
- с положительным зарядом на центральном томе углерода (а);
- положительным зарядом на крайнем метиленовом углероде (б).
Две метальные группы вследствие электронодонорности будут компенсировать положительный заряд на вторичном атоме углерода в большей степени, чем одна метиленовая группа на первичном атоме углерода. Следовательно, положительный заряд в катионе а делокализован в большей степени, он обладает меньшим запасом свободной энергии и устойчивее катиона б. Поэтому протон атакует крайний атом углерода пропилена. Очевидно, что третичный карбокатион в ряду:
$(R)_3C > (R)_2CH > RCH_2 > CH_3$
Значимость правила Марковникова
Сформулированные Марковниковым правила имеют и в настоящее время огромное значение для химиков-органиков. За 80—90 лет они подвергались неоднократной проверке. Было выяснено, при каких именно условиях они справедливы. Так, например, установлено, что присоединение бромистоводородной кислоты к несимметричным углеводородам идет против правила Марковникова, когда реакция протекает по радикальному механизму. В целом возражения вызвало, пожалуй, только правило, согласно которому хлор в хлоропроизводных облегчает дальнейшее замещение при том же атоме углерода. В действительности, например, оказалось, что при хлорировании монохлоридов в газовой фазе на свету второй атом хлора вступает чаще всего не к этому атому углерода, а к соседнему или даже еще более отдаленному.
В настоящее время электронные теории органической химии позволяют уже до известной степени объяснить внутренний механизм этих реакций, иными словами, механизм взаимного влияния атомов в реагирующих молекулах, и, таким образом, осуществляется та задача, решение которой было завещено Марковниковым будущим химикам.
http://sprint-olympic.ru/uroki/himija/98756-pravilo-markovnikova-formylirovka-i-primery-ispolzovaniia-v-himii.html
http://spravochnick.ru/himiya/nomenklatura_alkenov/orientaciya_pravilo_markovnikova/