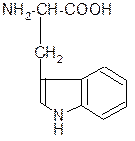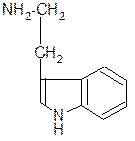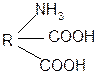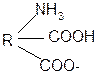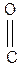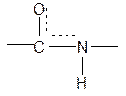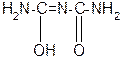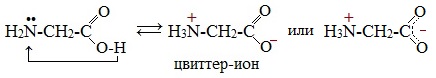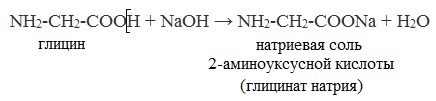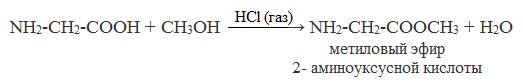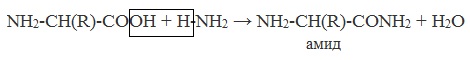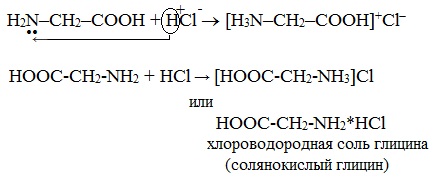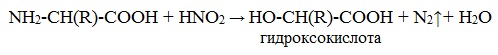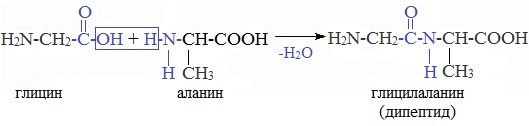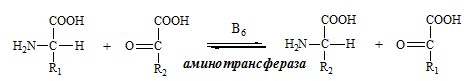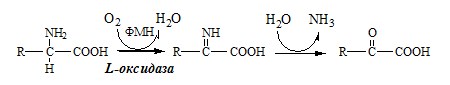III. Биологически важные реакции a- аминокислот
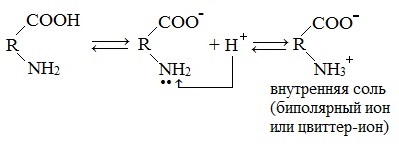
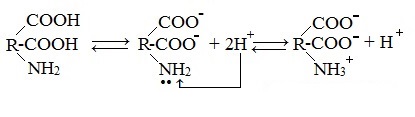
1. Способность к образованию внутренних солей (биполярных, или «цвиттер» – ионов). Карбоксильная группа проявляет кислотные свойства, диссоциирует с отщеплением протона. Амино-группа, которая проявляет основные свойства, способна протонироваться по неподеленной электронной паре атома азота. В результате в водных растворах и в кристаллическом состоянии аминокислоты существуют в виде внутренних солей:


Суммарный заряд молекулы зависит от строения радикала R и рН среды:
а) моноаминомонокарбоновая кислота:
б) моноаминодикарбоновая кислота:







в) диаминомонокарбоновая кислота:
 | |||
 |  |  |  |
 |
Свойство аминокислот изменять заряд при определенном значении рН, а следовательно, двигаться в электрическом поле к разным электродам лежит в основе метода электрофореза, который используется для разделения смесей аминокислот и белков.
Значение рН среды, при котором суммарный заряд молекулы равен нулю, называется изоэлектрической точкой (ИЭТ, или рНi , или pI). В ИЭТ молекула теряет электрофоретическую подвижность, снижается растворимость белка в воде, он может выпадать в осадок.
2. Реакция декарбоксилирования:
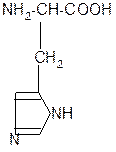

 |

В результате реакции декарбоксилирования a- аминокислот образуются биогенные амины, обладающие сильной физиологической активностью, многие из них являются аллергенами, большинство обладает сосудосуживающими свойствами (исключение – гистамин), участвуют в регуляции жизненно важных функций организма.
3. Реакции дезаминирования:
а) дезаминирование по Ван-Слайку in vitro:
глицин гликолевая кислота
По объему выделяющегося газообразного азота судят о количестве аминокислоты в растворе.
б) неокислительное дезаминирование in vivo протекает у низших организмов (бактерий, грибов):

в) окислительное дезаминирование in vivo:



NH2NH



a- кетоглутаровая кислота
Реакция протекает под действием фермента глутаматдегидрогеназы и кофермента
4. Реакция трансаминирования (переаминирования) in vivo:
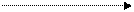
аланин a- кетоглутаровая
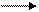
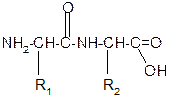

R 1 OHR2 OH
Последовательность аминокислот, соединенных между собой пептидными связями, является первичной структурой белков.
Процесс, обратный образованию пептида, называется гидролизом. Существуют три вида гидролиза белка: кислотный, щелочной и ферментативный. Результатом является образование смеси аминокислот, которые могут быть разделены и идентифицированы методами хроматографии или электрофореза.
Таким образом определяют аминокислотный состав белка.
Рассмотрим пример: Составить трипептид Глу-Асн-Про и дать ему полную
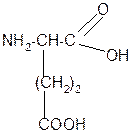

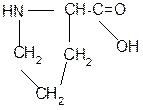
 |
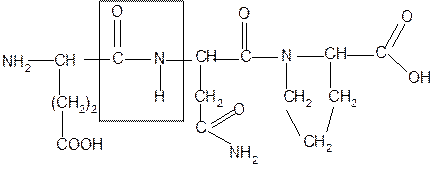 |
 |
В названии пептида окончания аминокислот меняются на «ил», кроме последней аминокислоты.
Характеристика пептида. 1. Реакция пептида на индикатор – кислотная, так как в пептиде две кислотные группы – СOOH и одна основная –NH2
(группа – С=О не проявляет основных свойств – см. классификацию)
2. Суммарный заряд пептида в водной среде:


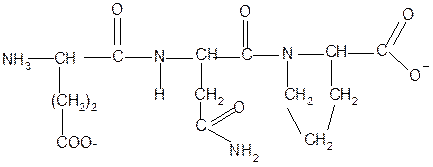








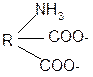

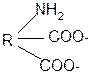


4. Изоэлектрическая точка пептида (определение см. выше) лежит в слабокислой
5. Поверхностные свойства пептида зависят от соотношения гидрофильных и
гидрофобных боковых радикалов и концевых групп.
В пептиде содержатся 4 гидрофильные группы: 2-СOOH, -C=O, + NH3
и одна гидрофобная: радикал пролина ½
Гидрофильных групп больше, поэтому поверхность пептида гидрофильна, он растворим в воде.
Пептиды являются продуктом частичного гидролиза белков. Но многие пептиды присутствуют в свободном состоянии в клетках и тканях и выполняют специфические биологические функции. К ним относятся гормоны, антибиотики и другие соединения, обладающие высокой биологической активностью.
Самостоятельное значение пептидов в процессах жизнедеятельности человеческого организма велико. В нервной ткани выделены нейропептиды, влияющие на функции нервной системы: энкефалины, эндорфины – «опиоидные» пептиды, аналогично морфину подавляющие боль; пептиды, действующие на сон; пептиды памяти и др.
Известны гормоны пептидной природы: окситоцин, вазопрессин (гормоны задней доли гипофиза), меланоцитстимулирующий гормон (выделяется средней долей гипофиза), адренокортикотропный гормон (АКТГ) (передней доли гипофиза), глюкагон (поджелудочной железы), гормоны желудочно-кишечного тракта и др.
К пептидам относятся токсины, выделенные из бледной поганки, токсины яда пчел, змей, скорпионов, морских позвоночных.
В медицине используются пептиды-антибиотики: грамицидин S, актиномицин и др.; пептиды-регуляторы иммунитета: тафцин; пептиды – заменители сахара: аспартам и т.д.
Строение пептидной связи

В результате связь C-N приобретает характер двоесвязанности, становится «полуторной». Вращение вокруг этой связи затруднено. В большинстве природных белков и пептидов имеет место транс-конфигурация пептидной связи, что важно для стабилизации вторичной структуры.


За счет лактимной формы пептиды дают качественную цветную реакцию с ионами Сu 2+ аналогично биурету – веществу, получаемому из 2 молекул мочевины:
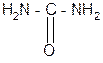
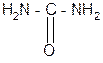

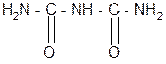
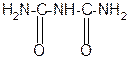
лактамная форма биурета лактимная форма биурета
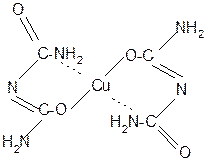 |
Эта реакция называется биуретовой. Она используется как качественная реакция для обнаружения пептидов и белков.
Дата добавления: 2015-09-28 ; просмотров: 1680 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Напишите уравнения биологически важных реакций аминокислот
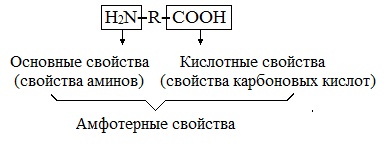
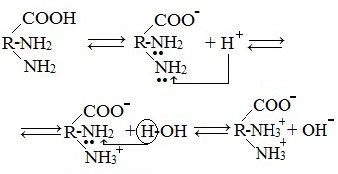
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
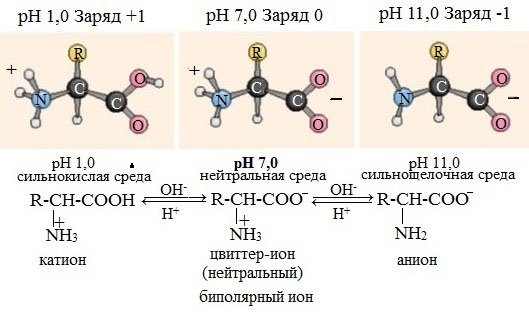
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
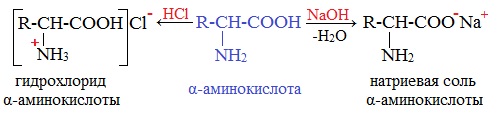
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
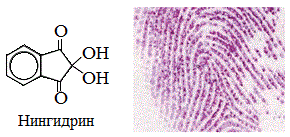
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
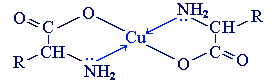
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты. Общие пути обмена аминокислот. Синтез мочевины.
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Аминокислоты. Общие пути обмена аминокислот. Биосинтез мочевины.
Аминокислоты – органические соединения, содержащие –СООН и -NH2 в α-положении. Почти все аминокислоты имеют хиральный атом и обладают оптической изомерией. У человека присутствуют L-аминокислоты
Всего известно около 300 видов аминокислот, у человека в организме – 70, а в составе белков – 20.
Аминокислоты. Физико-химические свойства
Аминокислоты белые кристаллические вещества, хорошо растворимые в воде. Имеют высокую температуру плавления, в твердом состоянии находятся в виде внутренней соли. Многие сладкие на вкус (гли).
Аминокислоты амфотерные вещества – проявляют свойства кислот и оснований.
К наиболее важным общим реакциям аминокислот относятся реакции:
- 1. декарбоксилирования,
- 2. переаминирования,
- 3. дезаминирования,
- 4. образование пептидных связей
- 5. образование оснований Шиффа (при гликозилировании белков).
Специфические реакции аминокислот связаны с наличием функциональных групп в радикале (окислительно-восстановительные реакции цис).
Аминокислоты. Классификация.
Классификация аминокислот по природе радикала:
- 1). алифатические (гли, ала, вал, лей, иле и.т.д.);
- 2). ароматические (фен, тир, три, гис);
- 3). гетероциклические (про, оксипро).
Классификация аминокислот по количеству карбоксильных и аминогрупп:
- 1). нейтральные;
- 2). кислые (глу, асп);
- 3) основные (арг, лиз).
Классификация аминокислот по функциональным группам в радикале:
- 1). содержащие –ОН (сер, тре);
- 2). содержащие –SH (цис, мет);
- 3). содержащие –СОNH2 (глн, асн);
Классификация аминокислот по способности к синтезу:
- 1. Аминокислоты, которые синтезируются в организме, называют заменимыми (глицин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, серии, пролин, аланин).
- 2. Аминокислоты, которые не синтезируются в организме, но для него необходимы, называются незаменимыми (фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин).
- 3. Аргинин и гистидин – частично заменимые аминокислоты , у взрослых они образуются в достаточных количествах, а у детей – нет. Поэтому, необходимо дополнительное поступление этих АК с пищей.
- 4. Тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты (фенилаланин и метионин).
Аминокислоты. Функции
- Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других аминокислот
- Служат источником азота при синтезе всех азотсодержащих небелковых соединений (нуклеотиды, гем, креатин, холин и др);
- Выполняют регуляторную функцию (гли, глу – нейромедиаторы);
- служат источником энергии для синтеза АТФ.
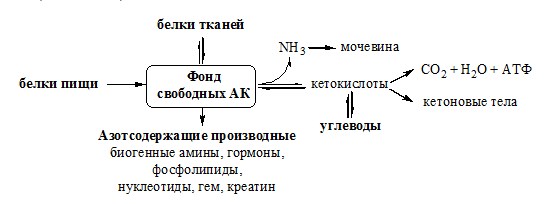
ПУТИ ОБРАЗОВАНИЯ ПУЛА АМИНОКИСЛОТ В КРОВИ
И ЕГО ИСПОЛЬЗОВАНИЕ В ОРГАНИЗМЕ
Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных аминокислот организма составляет примерно 35г.
Источниками аминокислот в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на аминокислоты около 400г белков, примерно такое же количество синтезируется. Специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде ТГ), не существует (исключение – казеин молока). Поэтому резервом аминокислот служат все белки тканей, но преимущественно белки мышц (т.к. их много).
ОБЩИЕ РЕАКЦИИ ОБМЕНА АМИНОКИСЛОТ
Аминокислоты, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена аминокислот относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (L переходы D).
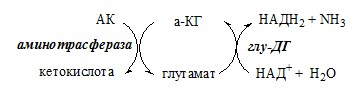
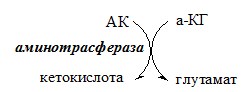
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ
Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая аминокислота. Процесс трансаминирования легко обратим, при нем общее количество аминокислот в клетке не меняется.
Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина).
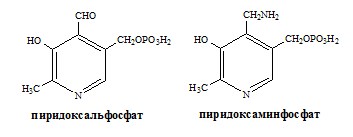
У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все аминокислоты, за исключением лизина, треонина и пролина.
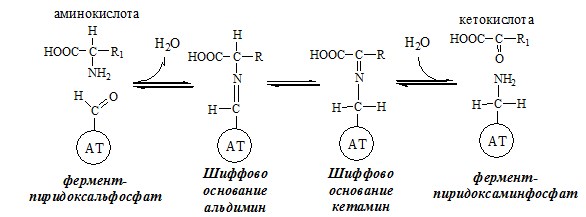
Механизм переаминирования
Вначале, аминоксилота передает свою аминогруппу на пиродоксальфосфат. Аминокислота при этом превращается в кетокислоту, а пиродоксальфосфат – в пиридоксаминфосфат.
Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат.
Органоспецифичные аминотрансферазы АЛТ и АСТ
Чаще всего в трансаминировании участвуют аминокислоты и кетокислоты, которых много в организме — глу, ала, асп, α-КГ, ПВК и ЩУК. Основным донором аминогруппы служит глу, а кетогруппы – α-КГ.
Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT).
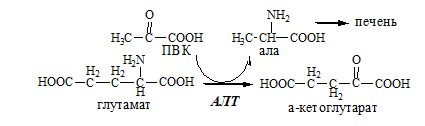
АЛТ катализирует реакцию трансаминирования между ала и α-КГ: ала+α-КГ↔ПВК+глу АЛТ локализуется в цитозоле клеток многих органов, больше всего ее в клетках печени и миокарде.
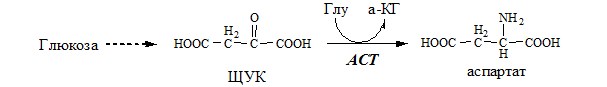
ACT катализирует реакцию трансаминирования между асп и α-КГ: асп+α-КГ↔ЩУК+глу
ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее ее количество обнаружено в миокарде и печени.
АСТ и АЛТ являются органоспецифичными ферментами, их определяют в крови для диагностики заболеваний печени, сердца и, в меньшей степени, скелетных мышц. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме он равен 1,33±0,42.
При инфаркте миокарда активность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза, коэффициент де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в – 8—10 раз по сравнению с нормой, a ACT — в 2—4 раза. Коэффициент де Ритиса снижается до 0,6.
Биологическое значение трансаминирования
Реакции трансаминирования обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование аминокислоты
Прямое дезаминирование – это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Существует 5 видов прямого дезаминирования аминокислот:
- 1. окислительное;
- 2. неокислительное;
- 3. внутримолекулярное;
- 4. восстановительное;
- 5. гидролитическое.
Окислительное дезаминирование – самый активный вид прямого дезаминирования аминокислот.
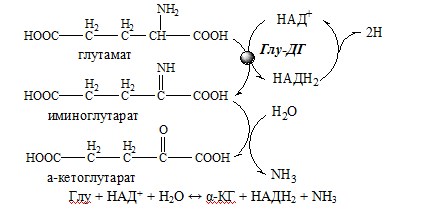
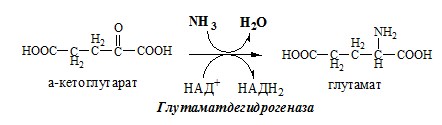
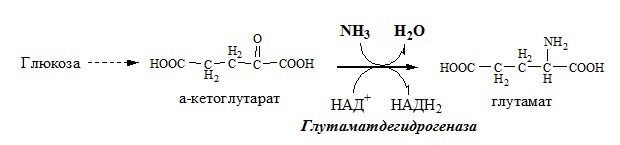
1. Глутаматдегидрогеназа (глу-ДГ) – олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом).
Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата).
Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3
2. Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
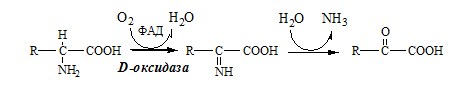
3. Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
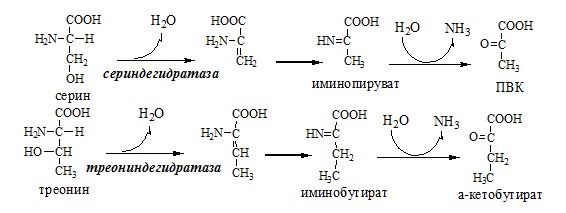
Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.
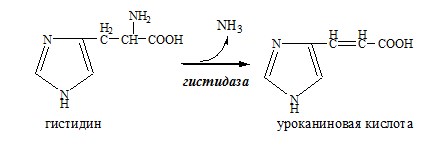
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Непрямое дезаминирование (трансдезаминирование) аминокислот
Непрямое дезаминирование – это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства аминокислот, так как они не способны к прямому дезаминированию (нет ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа аминокислоты переходит на кетосоединение (α-КГ, ИМФ).
На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Непрямое дезаминирование в печени
Непрямое дезаминирование аминокислоты происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы аминокислоты в результате трансаминирования переносятся на α-КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию.
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой АК из соответствующей α-кетокислоты.
При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм аминокислот и образование а-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Таким образом, Глу-ДГ играет ключевую роль в регуляции обмена аминокислот и энергии.
Непрямое дезаминирование в мышцах (и нервной ткани)
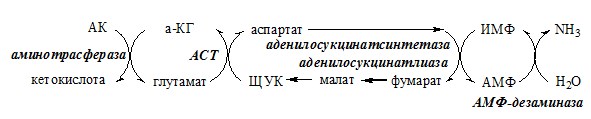
В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ.
Можно выделить 4 стадии этого процесса:
- 1. трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза);
- 2. трансаминирование глутамата с ЩУК, образование аспартата (АСТ);
- 3. реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза);
- 4. гидролитическое дезаминирование АМФ (АМФ-дезаминаза).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
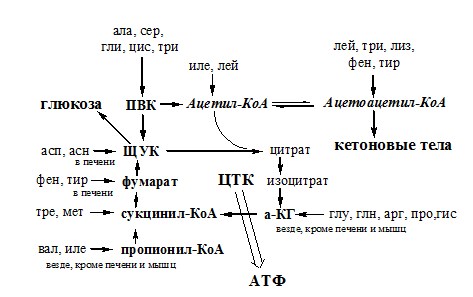
Пути обмена безазотистого остатка аминокислот
За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел.
Гликогенные аминокислоты – АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре).
Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел.
Смешанные (глико-кетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел.
ОБМЕН АММИАКА
Аммиак в организме образуется:
- при дезаминировании аминокислоты во всех тканях (много);
- при дезаминировании биогенных аминов и нуклеотидов во всех тканях (мало);
- при дезаминировании АМФ в интенсивно работающей мышце;
- при гниении белков в кишечнике.
Концентрация аммиака
Концентрация аммиака в сыворотке крови в норме 11—35 мкмоль/л. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония — NH4+, количество неионизированного NH3 невелико (
Токсичность аммиака
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и, прежде всего на ЦНС.
Механизм токсического действия аммиака:
- 1. Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глу-ДГ, в сторону образования глу:
α-Кетоглутарат + НАДH2 + NH3 → глу + НАД+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение реакции трансаминирования АК и снижение синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
снижения скорости ЦТК и развитие энергодефицита.
Недостаточность α-кетоглутарата ускоряет реакции синтеза ЩУК из ПВК, сопровождающейся интенсивным потреблением СО2 (особенно характерны для клеток головного мозга). - 2. Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону, вызывает алкалоз. Алкалоз увеличивает сродство гемоглобина к кислороду, что препятствует отдачи им кислорода. В результате развивается гипоксия тканей, энергодефицит, от которого главным образом страдает головной мозг.
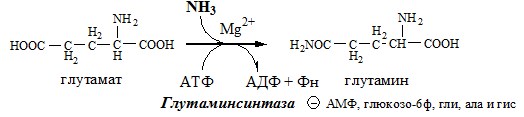
- 3. Высокие концентрации аммиака, при участии глутаминсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани:
- 4. Глу + NH3 + АТФ → Глн + АДФ + Н3РО4. Накопление глн в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызвает отёк мозга. Снижение концентрации глу нарушает обмен АК и нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
- 5. Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток NH4+ в крови нарушает трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
- 6. Низкие концентрации аммиака стимулируют дыхательный центр, а высокие – угнетают.
Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина
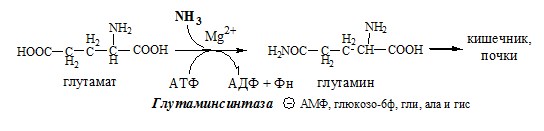
Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис.
Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки.
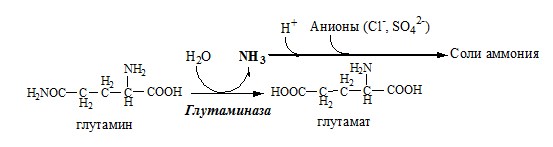
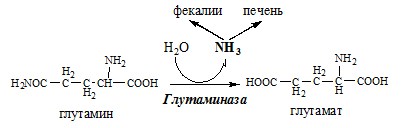
В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:
Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе.
В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
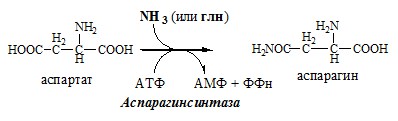
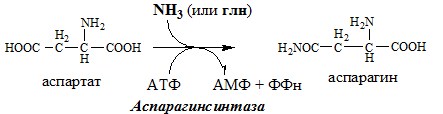
Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
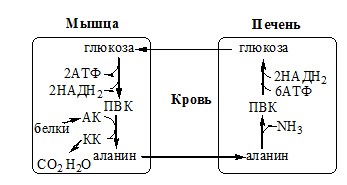
Обмен аланина
Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина.
В кишечнике:
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью.
В мышцах:
Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы.
Этот процесс называется глюкозо-аланиновый цикл:
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК.
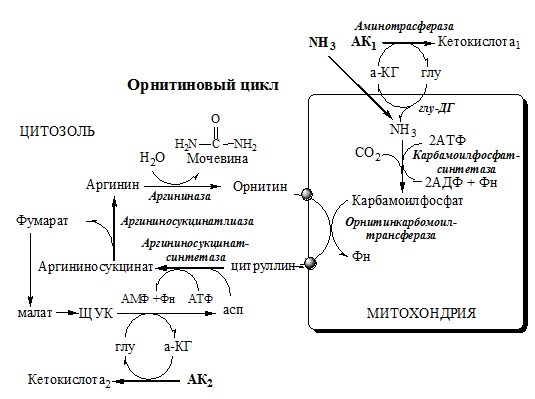
ОРНИТИНОВЫЙ ЦИКЛ
Большая часть свободного аммиака, а также аминного азота в составе (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека.
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт.
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота, один из аммиака, другой – из асп.
Реакции орнитинового цикла
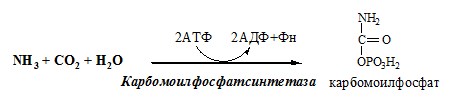
Предварительно в митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:
(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов).
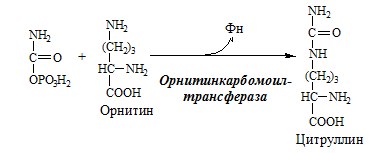
1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:
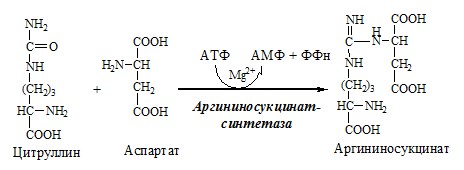
2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины.
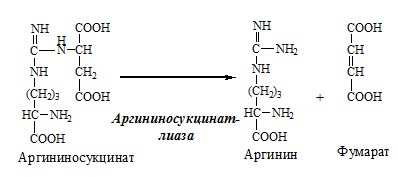
3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
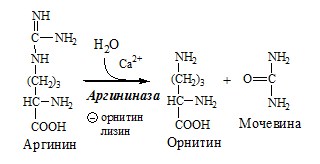
4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы – высокие концентрации орнитина и лизина.
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
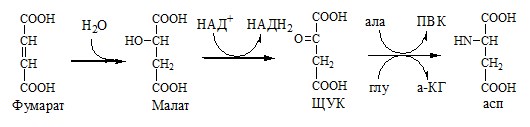
Регенерация аспартата из фумарата
Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника:
Малат может направиться в митохондрии и включиться в ЦТК.
Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.
Общее уравнение синтеза мочевины:
CO2 + NH3 + асп + 3 АТФ + 2 Н2О → мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн
Энергетический баланс орнитинового цикла
На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины.
Энергозатраты при этом частично компенсируются:
- при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ;
- в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ;
Орнитиновый цикл в печени выполняет 2 функции:
- 1. превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
- 2. синтез аргинина и пополнение его фонда в организме.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут.
ГИПЕРАММОНИЕМИЯ
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм.
Причинами гипераммониемии могут быть:
1. генетические дефекты ферментов орнитинового цикла в печени;
2. вторичное поражение печени в результате цирроза, гепатита или других заболеваний.
Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла.
Наследственные нарушения орнитинового цикла и их основные проявления
Гиперам-мониемия, тип I
В течение 24-48 ч после рождения кома, смерть
Гиперам-мониемия, тип II
Сцепленный с Х-хромосомой
Гипотония, снижение толерантности к белкам
Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки
Гипераммониемия, атаксия, судороги, выпадение волос
Аргини-носукцинат NH 3
Аргини-носукци-нат, Глн, Ала, Лиз
Apг
Лиз Орнитин
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой.
Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л), глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, тремор, судорожные припадки;
- нечленораздельная речь;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме).
В тяжёлых случаях развивается кома с летальным исходом.
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС.
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов АК в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
- путём связывания и выведения NH3 в составе фенилацетилглутамина и гиппуровой кислоты. Пищевой фенилацетат при конъюгации с глутамином образует фенилацетилглутамин, а пищевой бензоат при конъюгации с глицином образует гиппуровую кислоту, которые потом выводится с мочой;
- повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций. Введение больших доз цитруллина стимулирует синтез мочевины из аспартата. Большие дозы аргинина стимулируют регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
Обмен аминокислот и аммиака между тканями
Печень
В печень азот поступает в основном в виде аммиака, глутамина, аланина, а меньше в виде других аминокислот в основном из мышц и кишечника. Поглощает аминокислоты с разветвленной цепью (вал, лей, иле). Синтезирует глюкозу в основном из аланина и серина.
Мышцы
Поглощают аминокислоты с разветвленной цепью (вал, лей, иле). Выделяют много аланина и глутамина меньше других аминокислот.
Кишечник
Поглощает глутамин. Выделяет много аланина. С пищей из кишечника поступают все аминокислоты.
Мозг
Поглощает много аминокислот с разветвленной цепью (вал, лей, иле). Выделяет много глутамина.
Почки
Поглощают глутамин. Выделяют много серина и немного аланина.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
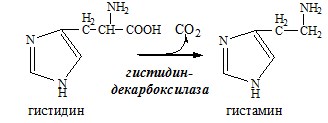
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования.
Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы).
Серотонин
Серотонин образуется из триптофана в надпочечниках, ЦНС и тучных клетках.
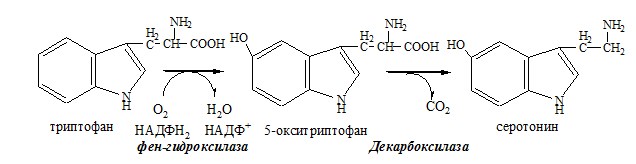
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
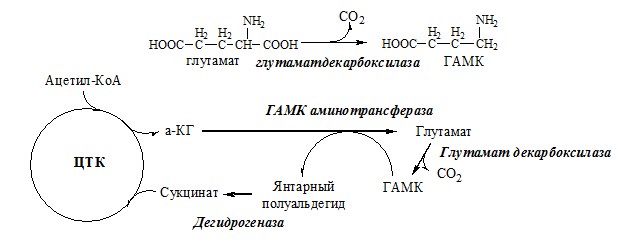
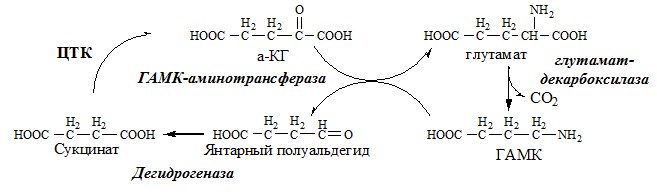
ГАМК
ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию.
ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.
Гистамин
Гистамин образуется в тучных клетках. Секретируется в кровь при повреждении ткани, развитии иммунных и аллергических реакций.
Гистамин – медиатор воспаления, аллергических реакций, пищеварительный гормон:
- 1. стимулирует секрецию желудочного сока, слюны;
- 2. повышает проницаемость капилляров, расширение сосудов, покраснение кожи, вызывает отеки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
- 3. сокращает гладкую мускулатуру легких, вызывает удушье;
- 4. вызывает аллергическую реакцию;
- 5. нейромедиатор;
- 6. медиатор боли.
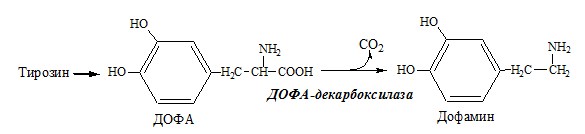
Дофамин
Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников.
Дофамин – нейромедиатор среднего отдела мозга.
Аминокислоты. Специфические пути обмена аминокислот
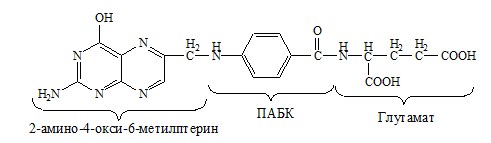
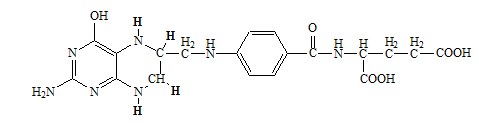
ФОЛИЕВАЯ КИСЛОТА
Значительную роль в обмене ряда АК, синтезе некоторых сложных липидов, нейромедиаторов, гормонов и ряда других веществ играют производные фолиевой кислоты.
Фолиевая кислота широко распространёна в продуктах животного и растительного происхождения, синтезируется микрофлорой кишечника.
Активная форма фолиевой кислоты – ТГФК. Она образуется в печени при восстановлении фолиевой кислоты с участием фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит НАДФН2.
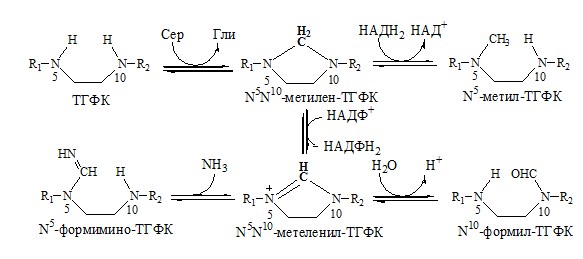
Образование одноуглеродных фрагментов, их взаимопревращения
ТГФК принимает от АК одноуглеродные фрагменты: серин и глицин дают метиленовый фрагмент (-СН2-), гистидин – формимино- и формильный фрагменты.
В составе ТГФК одноуглеродные фрагменты могут подвергаться взаимопревращениям: метиленовая группа превращаться в метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).
Затем ТГФК отдает одноуглеродные фрагменты на:
- синтез пуриновых оснований
- синтез тимидиловой кислоты
- регенерацию метионина
- превращение дУМФ в дТМФ;
- превращение глицина в серина и т.д.
Недостаточность фолиевой кислоты
Гиповитаминоз фолиевой кислоты возникает редко, его вызывает использование сульфаниламидных препаратов. Сульфаниламиды — структурные аналоги парааминобензойной кислоты, они ингибируют синтез фолиевой кислоты у микроорганизмов, вызывая их гибель. Некоторые производные птеридина (аминоптерин и метотрексат) тормозят рост почти всех организмов, нуждающихся в фолиевой кислоте, их используют для подавления опухолевого роста у онкологических больных.
Гиповитаминоз фолиевой кислоты приводит к:
- 1. мегалобластической (макроцитарной) анемии. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина — нарушение синтеза ДНК и РНК из-за недостатка тимидиловой кислоты и пуриновых нуклеотидов.
- 2. лейкопении;
- 3. задержке роста.
- 4. нарушению регенерации эпителия, особенно в ЖКТ (связано с недостатком нуклеотидов для синтеза ДНК в постоянно делящихся клетках слизистой оболочки).
КОБАЛАМИН (В12)
В12 синтезируется только микроорганизмами, им богаты печень, почки. Активные формы кобаламина – метилкобаламин (цитоплазма) и дезоксиаденозилкобаламин (митохондрии).
Кобаламин участвует:
1. в передачи метила с метил-ТГФК на гомоцистеин при регенерации метионина.
2. в превращениях одноуглеродных фрагментов в составе ТГФК.
3. в метаболизме жирных кислот с нечетным числом атомов С и аминокислот с разветвленной цепью. Перенос протонов в реакциях изомеризации.
Недостаточность В12
Гиповитаминоз возникает при нарушении всасывании В12 (дефицит фактора Касла при пониженной кислотности желудочного сока).
Гиповитаминоз В12 сопровождается:
1. макроцитарной (мегалобластической) анемией: снижение числа эритроцитов, гемоглобина, увеличение размера эритроцитов. Причина — нарушение синтеза ДНК.
2. расстройствами деятельности нервной системы. При распаде жирных кислот с нечетным количеством атомов С и разветвленных АК из-за дефицита В12 накапливается нейротоксичная метилмалоновая кислота.
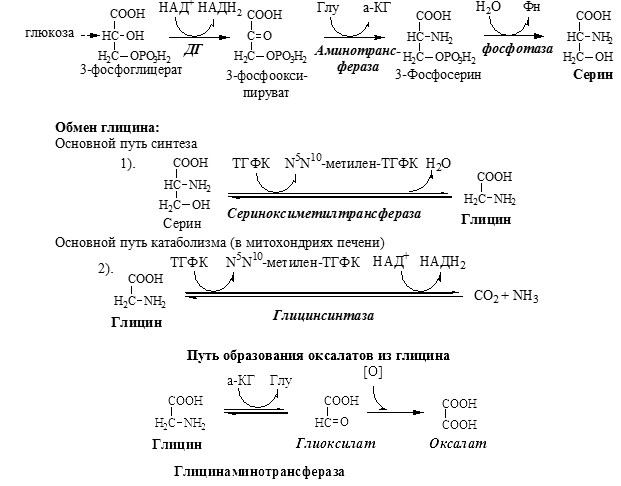
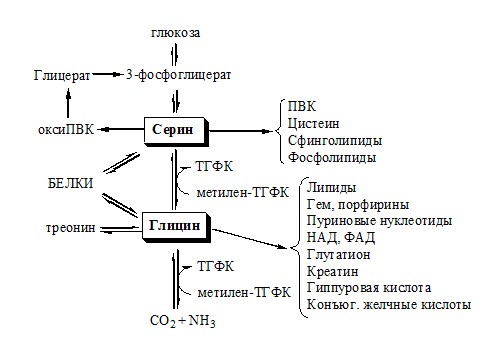
ОБМЕН СЕРИНА И ГЛИЦИНА
Серин и глицин – заменимые аминокислоты.
Синтез серина и глицина. Основной путь катаболизма глицина.
Схема путей обмена серина и глицина
Серии и глицин выполняют в организме человека разнообразные и очень важные функции.
Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга.
Наследственные нарушения обмена глицина
Известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность ферментов или дефект системы транспорта этой АК.
Гиперглицинемия возникает при дефекте глицинрасщепляющей системы. Проявляется повреждением мозга, судорогами, гипотонией, нарушением дыхания.
Глицинурия характеризуется повышенным выделением глицина с мочой (до 1 г/сут) при нормальном содержании его в крови. Причиной является нарушение реабсорбции глицина в почках.
Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. Дефект глицинаминотрансферазы блокирует превращение глиоксилата снова в глицин. Глицин → глиоксилат → оксалат
Прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии.
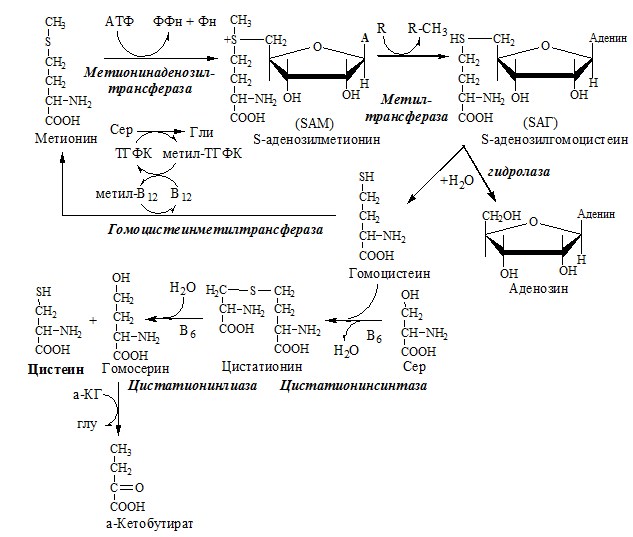
В состав белков человека входят 2 АК, содержащие серу, — метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой.
МЕТИОНИН
Метионин — незаменимая аминокислота, может регенерировать из гомоцистеина с участием серина и глицина. Метионин:
1. участвует в синтезе белков организма;
2. является источником метильной группы, используемой в реакциях трансметилирования;
3. является источником атома серы, необходимого для синтеза цистеина;
4. участвует в реакциях дезаминирования;
5. Метионил-тРНК участвует в инициации процесса трансляции.
Образование S-аденозилметионина
Метильная группа в метионине прочно связана с серой, поэтому донором этого одноуглеродного фрагмента служит активная форма метионина – S-аденозилметионин (SAM). (SAM — нестабилен т.к. сера при валентности 2 имеет 3 связи). SAM образуется при присоединении метионина к аденозину с участием метионинаденозилтрансферазы (есть во всех типах клеток). Аденозин образуется при гидролизе АТФ.
Ресинтез метионина, роль ТГФК и витамина В12.
Связь обменов метионина и цистеина
Реакции трансметилирования с участием S-аденозилметионина
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
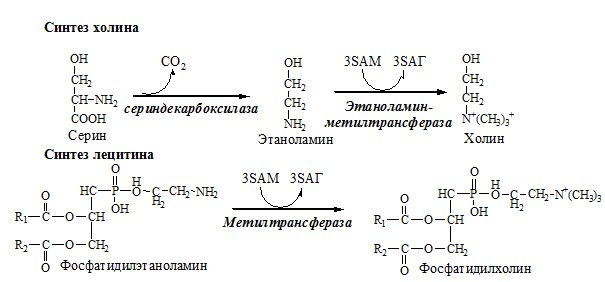
Синтез холина и синтез лецитина
Аналогично синтезируются:
1. из ГАМК → карнитин;
2. из гуанидинацетата → креатин;
3. из норадреналина → адреналин;
4. из карнозина → анзерин;
5. Реакции трансметилирования используются также в синтезе азотистых оснований, инактивации гормонов, нейромедиаторов и обезвреживании ксенобиотиков.
ЦИСТЕИН
Цистеин – серосодержащая условнозаменимая АК. Синтезируется из незаменимого метионина и заменимого серина.
Нарушение синтеза цистеина возникает при гиповитаминозе фолиевой кислоты, В6, В12 или наследственных дефектах цистатионинсинтазы и цистатионинлиазы. Гомоцистеин превращается в гомоцистин, который накапливается в крови, тканях и выделяется с мочой.
Обмен цистеина: схема путей, их значение.
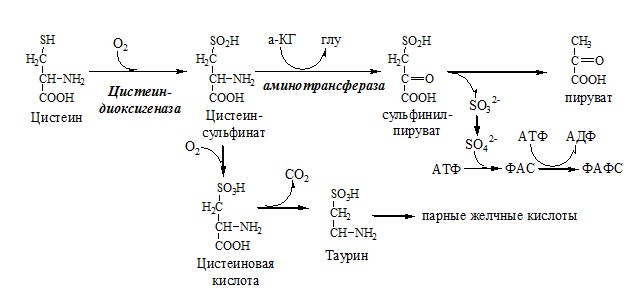
Цистеин:
- 1. используется в белках для формирования третичной структуры (дисульфидные мостики);
- 2. SH группы цистеина формируют активный центр многих ферментов;
- 3. идет на синтез глутатиона, таурина (парные желчные кислоты), НS-КоА, ПВК (глюкоза);
- 4. Является источником сульфатов, которые идут на синтез ФАФС или выделяются с мочой.
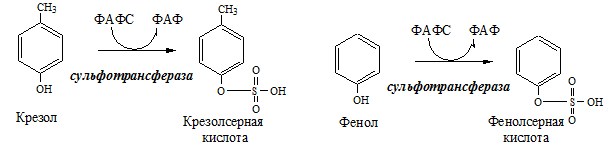
Образование сульфат-иона, его утилизация (образование ФАФС).
ФАФС используется:
1. В обезвреживании ксенобиотиков:
2. В синтезе гликозаминогликанов (сульфирование ОН групп производных глюкозы, галактозы сульфотрансферазой).
ФЕНИЛАЛАНИН
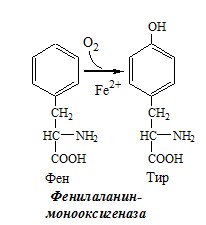
Фенилаланин — незаменимая АК, которая содержится в достаточных количествах в пищевых продуктах. Фенилаланин идет в основном на синтез белков и тирозина.
Превращение фенилаланина в тирозин необратимо катализирует фенилаланингидроксилаза (монооксигеназа), коферментом которой служит тетрагидробиоптерин (Н4БП), кофактором – Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием НАДФH2.
Реакция необходима для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
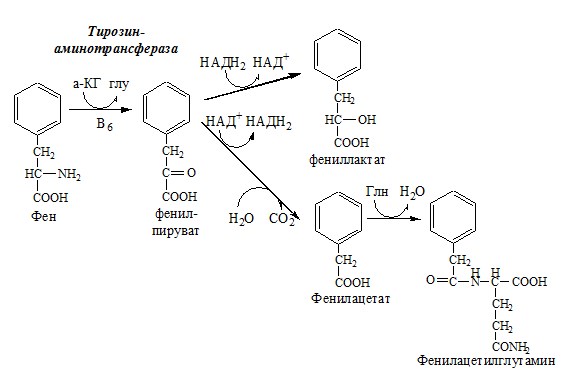
Фенилкетонурия
В печени здоровых людей небольшая часть фенилаланина (10%) превращается в фениллактат и фенилацетилглутамин. При дефекте фенилаланингидроксилазы этот путь катаболизма фенилаланина становится главным, что способствует развитию фенилкетонурии (ФКУ).
Классическая фенилкетонурия— наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы (частота 1:10000 новорождённых), которые приводят к снижению активности фермента или полной его инактивации.
При ФКУ концентрация фен повышается в крови в 20—30 раз, в моче — в 100—300 раз по сравнению с нормой. В крови и моче повышается содержание метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглутамина.
Проявления фенилкетонурии:
1. нарушение умственного и физического развития;
2. судорожный синдром;
3. нарушение пигментации.
Проявления фенилкетонурии связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону «пожизненной диеты». При отсутствии лечения больные не доживают до 30 лет.
Для диагностики фенилкетонурии используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче.
Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину.
ТИРОЗИН
Тирозин — условно заменимая АК, образуется из незаменимого фенилаланина. Содержание тир в пищевых белках достаточно велико.
Тирозин используется в синтезе белков, катехоламинов, тиреоидных гормонов и меланинов.
Обмен тирозина зависит от типа тканей.
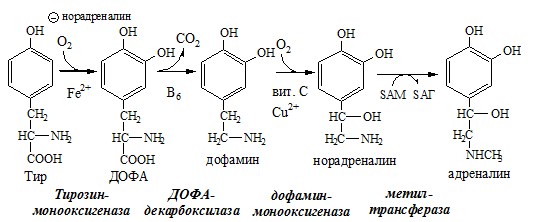
1. Обмен тирозина в надпочечниках и нервной ткани
В мозговом веществе надпочечников и нервной ткани тирозин метаболизирует по катехоламиновому пути с образованием дофамина, норадреналина и адреналина (только в надпочечниках).
Тирозингидроксилаза (тирозинмонооксигеназа) Fe2+ -зависимый фермент, в качестве кофермента использующий Н4БП. Ее ингибирует норадреналин.
Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин — гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов — регуляция деятельности ССС.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества. Снижение в нервных клетках содержания дофамина и норадреналина часто приводит к депрессивным состояниям. При шизофрении в височной доле мозга наблюдается гиперсекреция дофамина.
Болезнь Паркинсона
Болезнь Паркинсона развивается при снижении активности тирозинмонооксигеназы и ДОФА-декарбоксилазы, что приводит к недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). Заболевание сопровождается акинезией (скованность движений), ригидностью (напряжение мышц) и тремором (непроизвольное дрожание).
Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма используют заместительную терапию препаратами-предшественниками дофамина (производными ДОФА) — леводопа, мадопар, наком и др. Также подавляют инактивацию дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
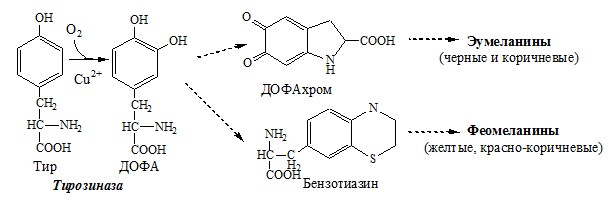
2. Обмен тирозина в меланоцитах
В пигментных клетках (меланоцитах) обмен тирозин идет по меланиновому пути. Из тирозина синтезируются пигменты — меланины 2 типов: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) — нерастворимые высокомолекулярные полимеры 5,6-дигидроксииндола. Феомеланины — жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах.
Меланины присутствуют в сетчатке глаз, в составе волос, в коже. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов.
Альбинизм
При наследственном дефекте тирозиназы (1:20000) в меланоцитах нарушается синтез меланинов и развивается альбинизм.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи, сетчатки глаз и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи.
3. Превращение тирозина в щитовидной железе
В щитовидной железе из тирозина синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин.
4. Катаболизм тирозина в печени
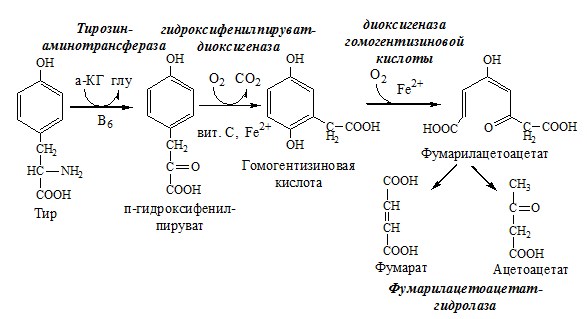
Катаболизм тирозина происходит в печени по гомогентизиновому пути (схема).
Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат — кетоновое тело, окисляемое до СО2 и Н2О с выделением энергии.
Алкаптонурия («чёрная моча»)
При наследственном дефекте диоксигеназы гомогентизиновой кислоты (2—5 случаев на 1 млн новорождённых) развивается алкаптонурия. При алкаптонурии происходит накопление в организме гомогентизиновой кислоты, избытки которой выделяются с мочой. На воздухе гомогентизиновая кислота окисляется с образованием тёмных пигментов – алкаптонов.
Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит.
Тирозинемии
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозинурии.
Различают 3 типа тирозинемии.
- 1. Тирозинемия типа 1 (тирозиноз). Причиной заболевания является дефект фумарилацетоацетатгидролазы. Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления — диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6—8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
- 2. Тирозинемия типа II (синдром Рихнера—Ханхорта). Причина — дефект тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
- 3. Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифенилпируватдиоксигеназы. В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенилаланина. При лечении назначают бедную белком диету и витамин С.
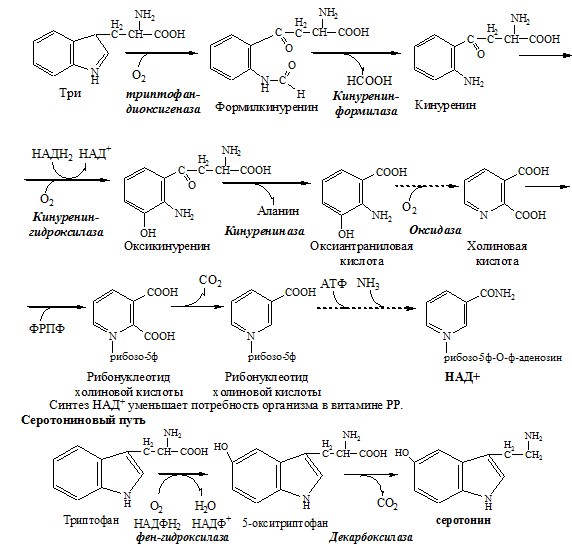
ТРИПТОФАН
Триптофан – незаменимая АК. В физиологических условиях >95% триптофана метаболизирует по кинурениновому пути и 1% по серотониновому пути.
Схема кинуренинового пути
Серотонин образуется в надпочечниках, ЦНС и тучных клетках.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Образование и использование в организме ГАМК и ГОМК. Антиоксидантные, антигипоксические и адаптогенные свойства Глу, Асп, их клиническое применение.
ГЛУТАМАТ
Синтез глутамата
Глутамат образуется:
1). при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой:
2). В реакция переаминирования с участием аминотрансфераз:
Использование глутамата
- 1. Используется в синтезе белков, липидов, углеводов;
- 2. Ведущая роль в интеграции азотистого обмена. Обеспечивает реакции переаминирования АК: глутамат универсальный донор аминогруппы для синтеза заменимых АК (Ала, Асп, Асн, Сер, Гли, Глн, Про). Обеспечивает непрямое дезаминирование большинства АК. Участвует в обезвреживании аммиака с образованием глутамина;
- 3. Является источником α-КГ, необходимого для ЦТК и синтеза АТФ;
- 4. Входит в состав глутатиона;
Глутамат содержится в больших количествах в головном мозге, где выполняет разнообразные функции:
- 1. один из основных возбуждающих нейромедиаторов в коре, гиппокампе, полосатом теле и гипоталамусе;
- 2. используется для синтеза тормозного нейромедиатора ГАМК;
- 3. В виде пироглутамата (циклическая форма) входит в состав нейропептидов — люлиберина, тиролиберина, нейротензина, бомбезина и др.;
- 4. участвует в регуляции процессов памяти;
- 5. глутамат служит источником янтарной кислоты (сукцинат), которая может окисляться при гипоксии, давая АТФ (антигипоксант);
- 6. участвует в обезвреживании аммиака с образованием глутамина
Нарушение обмена глутамата приводит к целому ряду патологических нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетососудистой дистонии, эпилепсии (в качестве предшественника ГАМК — тормозного медиатора).
ГЛУТАМИН
Синтез глутамина
Использование глутамина
1. Используется в синтезе белков, углеводов;
2. Источник азота в синтезе пуриновых и пиримидиновых оснований, аспарагина, аминосахаров;
3. Обеспечивает транспорт азота из тканей;
АСПАРТАТ
Синтез аспартата
Использование аспартата
1. Используется в синтезе белков, липидов, углеводов;
2. Участвует в орнитиновом цикле при синтезе мочевины;
3. Участвует в синтезе карнозина, анзерина, пуриновых и пиримидиновых нуклеотидов, N-ацетиласпарагиновой кислоты.
АСПАРАГИН
Синтез аспарагина
Использование аспарагина
1. Используется в синтезе белков, липидов, углеводов;
http://himija-online.ru/organicheskaya-ximiya/aminokisloty/ximicheskie-svojstva-aminokislot.html
http://farmf.ru/lekcii/aminokisloty-obshhie-puti-obmena-aminokislot-sintez-mocheviny/