Напишите уравнения для предложенных превращений
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Можно ли записать реакцию в виде Сu(NO3)2=CuO+N2O5
Нет, потому что разложение нитрата меди выглядит так
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для третьего превращения:
4)
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
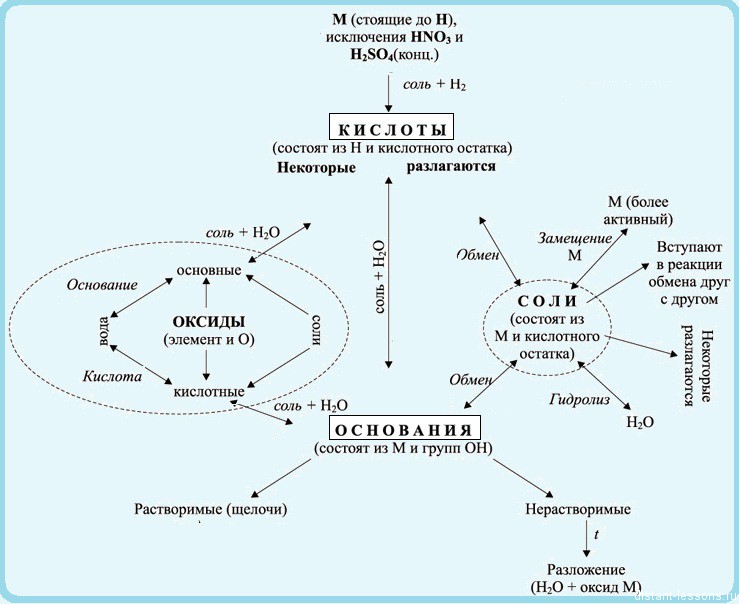
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
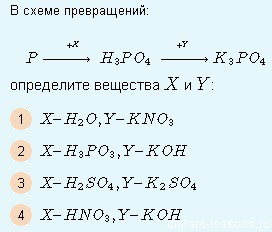
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
Как правильно решать задачи на составление схем превращений веществ?
Задание 1.
Установить генетическую цепочку получения карбоната кальция: А кальций оксид; Б кальций гидроксид; В кальций; Г кальций карбонат. Записать уравнения соответствующих реакций.
Решение:
Схема превращений веществ (составить уравнения соответствующих реакций):
А Б В Г
Са → CaO → Ca(OH)2 → Ca → CaCO3
Уравнения соответствующих реакций:
Задание 2.
Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить превращения по схеме:
Fe→ Fe(SO4) 3 → FeCI 3 → Fe(NO 3 ) 3 → Fe 2 O 3 .
Для окислительно-восстановительных реакций укажите окислитель и восстановитель.
Решение:
уравнения химических реакций:
В данной реакции происходит окисление железа до степени окисления +3, т.е. железо – восстановитель. При этом в реакции происходит восстановление серы (VI) до серы (IV). т.е. сера – окислитель.
Полная ионная форма уравнения реакции:
2Fe 0 + 12Н 0 + SO4 2- = 2Fe 3+ + 3 SO 4 2- + 3SO2↑ + 6H 2 O.
Полная ионная форма уравнения реакции:
2 Fe 3+ + 3 SO 4 2- + 3Ва 2 + + 6Cl — = 2 Fe 3+ + 6 Cl — + 3ВаSO4 ↓ ;
Сокращенное ионное уравнение реакции:
3 Ва 2 + + 3 SO 4 2- = 3 ВаSO 4 ↓ .
3). FeCl 3 + 3HNO 3 → Fe(NO 3 ) 3 + 3HCl — реакция обмена;
Полная ионная форма уравнения реакции:
Fe 3+ + 3 Cl — + 3Ag + + 3NO3 — = Fe 3+ + 3 NO 3 — + 3AgCl ↓ .
Сокращенное ионное уравнение реакции:
3 Ag + + 3 Cl — = 3AgCl↓.
4). 4Fe(NO 3 ) 3 → Fe2O 3 + NO2 ↑ + O2 ↑ — реакция разложения нитрата железа (III) при нагревании его. При этом происходит окисление-восстановление. – В данной реакции происходит окисление кислорода до степени окисления 0, т.е. кислород – восстановитель. При этом в реакции происходит восстановление азота (V) до азота (IV). т.е. азот – окислитель.
http://distant-lessons.ru/sostavit-uravneniya-reakcij-po-sxeme-prevrashhenij.html
http://buzani.ru/zadachi/obshchaya-khimiya/804-skhemy-prevrashchenij-veshchestv-zadanie-1-2