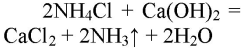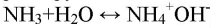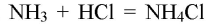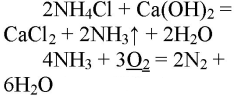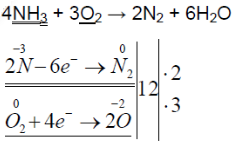Напишите уравнения электролитической диссоциации: а) хлорида кальция; б) гидроксида калия; в) соляной кислоты; г) сульфата железа(iii); д) фосфата натрия
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Напишите уравнения электролитической диссоциации хлорида кальция гидроксида
Вопрос по химии:
Напишите пожалуйста ответ. Напишите уравнения электролитической диссоциации: а)гидроксид кальция;б)хлорида меди(2);в) серной кислоты;г)сульфата железа(3);д)нитрата калия.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
Ca(OH)2 ⇔Ca(2+) + 2OH(-)
CuCl2 ⇔Cu(2+) + 2Cl(-)
H2SO4 ⇔2H(+) + SO4(2-)
Fe2(SO4)3 ⇔2Fe(3+) + 3SO4(2-)
KNO3 ⇔K(+) + NO3(-)
А) Ca(OH)₂ → Ca²⁺ + 2OH⁻
б) CuCl₂ → Cu²⁺ + 2Cl⁻
в) H₂SO₄ → 2H⁺ + SO₄²⁻
г) Fe₂(SO₄)₃ → 2Fe³⁺ + 3SO₄²⁻
д) KNO₃ → K⁺ + NO₃⁻
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
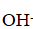
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
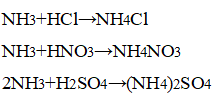
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
http://online-otvet.ru/himia/5cea7cc696f4e19a290ca305
http://gdzwow.com/answers/9-himiya-uch-rudzitis-vopr-k-par-25.html