Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
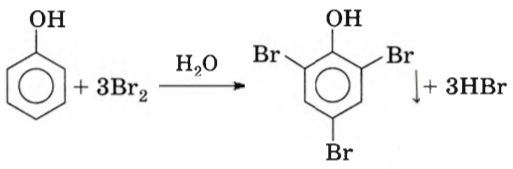
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Напишите уравнения фенола с бромной водой
При взаимодействии фенола с бромной водой образуется нерастворимый в воде 2,4,6-трибромфенол (качественная реакция на фенол). При действии избытка бромной воды на 240 г водного раствора фенола получено 8,45 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
`m(C_6H_2Br_3OH) = 8.45 г`
`C_6H_5OH + 3Br_2 ⟶ C_6H_2Br_3OH»↓» + 3HBr`
`n(C_6H_2Br_3OH) = (m(C_6H_2Br_3OH))/(M(C_6H_2Br_3OH)) = 8.45/331 = 0.0255″ моль»`
`n(C_6H_5OH) = n(C_6H_2Br_3OH) = 0.0255″ моль»`
`m(C_6H_5OH) = n(C_6H_5OH)*M(C_6H_5OH) = 0.0255*94 = 2.4 г`
`ω(C_6H_5OH) = (100*m(C_6H_5OH))/(m(«р-ра»)) = (100*2.4)/240 = 1%`
Напишите уравнения фенола с бромной водой
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Приведите молекулярную и структурную формулы фенола.
Молекулярная формула фенола: C6H5OH.
Структурная формула фенола: 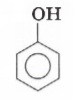
Найдите черты сходства и различия в строении молекул фенола и этанола.
Сходство: молекулы имеют в своём составе гидроксильную группу ОН, которая связана с атомом углерода.
Различия: в молекуле фенола гидроксильная группа связана с ароматическим радикалом, а в этаноле ― с алкильным радикалом.
Задание 2 Как взаимное влияние фенильного радикала и гидроксильной группы отражается на свойствах фенола? Ответ проиллюстрируйте уравнениями химических реакций.
Влияние фенильного радикала –C6H5 на гидроксильную группу выражается в значительном усилении кислотных свойств, так, например, фенол, в отличие от спиртов, вступает в реакцию нейтрализации со щелочами:
C6H5OH + NaOH ⟶ C6H5ONa + H2O
Влияние гидроксильной группы на фенильный радикал –C6H5 выражается в значительном облегчении протекания реакции по фенильному радикалу, так, например, для бромирования фенола, в отличие от бензола, не требуется катализатор и замещаются сразу три атома водорода в положениях 2, 4 и 6 с образованием белого нерастворимого осадка 2,4,6-трибромфенола:
Задание 3
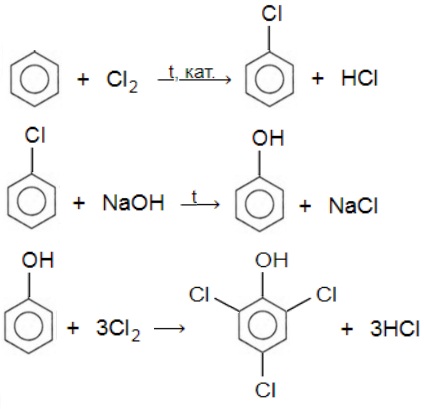
В настоящее время вместо фенола в качестве дезинфицирующего средства используют 2,4,6-трихлорфенол. Предложите способ его получения исходя из бензола. Напишите уравнения соответствующих реакций.
или
С6H6 + Cl2 t,кат. ⟶ C6H5Cl + HCl
C6H5Cl + NaOH t ⟶ C6H5OH + NaCl
C6H5OH + 3Cl2 ⟶ C6H2Cl3OH + 3HCl
Задание 4
В результате взаимодействия 47 г водного раствора фенола с бромной водой выпало 1,655 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Дано: m(раствора)=47 г, m(C6H2 Br3OH )=1,655 г
Найти: ω(C6H5OH)—?
Решение
1. Количество вещества осадка рассчитываем по формуле: n=m/M, где M ― молярная масса.
M( C6H2Br3OH )=331 г/моль
n( C6H2Br3OH )=m( C6H2 Br3OH )/M( C6H2 Br3OH )=1,655 г : 331 г/моль=0,005 моль
2. Составим химическое уравнение:
C6H5OH + 3Br2 = C6H2Br3OH↓ + 3HBr
По уравнению реакции n(C6H5OH):n(C6H2Br3OH)=1:1, количество вещества одинаковое, поэтому
n( C6H5OH )=n( C6H2 Br3OH )=0,005 моль
3. Рассчитываем массу фенола количеством вещества 0,005 моль по формуле: m = n • M, где M ― молярная масса.
M ( C6H5OH )=94 г/моль
m( C6H5OH )=n ( C6H5OH ) • M( C6H5OH )=0,005 моль • 94 г/моль=0,47 г
4. Рассчитываем массовую долю фенола в растворе:
ω ( C6H5OH )=( m ( C6H5OH ):m(раствора)) • 100%=(0,47 г : 47 г) •100%=1%
Ответ: 1%
Задание 5
В трёх пробирках без подписи находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов?
Качественной реакцией на фенол является реакция с бромной водой при комнатной температуре, в результате образуется белый осадок.
Качественной рекцией на глицерин (мноатономный спирт) является реакция со свежеполученным осадком гидроксида меди (II), в результате которой образуется раствор ярко-синего цвета.
Определить раствор пропанола-1 можно при помощи оксида меди (II), при его добавлении, наблюдается окисление спирта до альдегида, и раствор приобретает фруктовый запах.
Задание 6
Фенолят натрия взаимодействует с углекислым газом с образованием гидрокарбоната натрия и фенола согласно уравнению C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3 Какой вывод относительно кислотных свойств фенола и угольной кислоты можно сделать на основании этой реакции? Фенол является слабой кислотой, при этом кислотные свойства фенола настолько слабые, что даже такая слабая кислота, как угольная, вытесняет фенол из раствора его солей .
Задание 7
Опишите физические свойства фенола.
Фенол ― бесцветные кристаллы, розовеющие при хранении на воздухе, с температурой плавления 41°C и температурой кипения 181,2°C, летучие, имеют специфический стойкий запах (запах гуаши, или так называемый «карболовый запах»). При комнатной температуре фенол растворим в воде незначительно, а при нагревании до 70°С растворяется полностью.
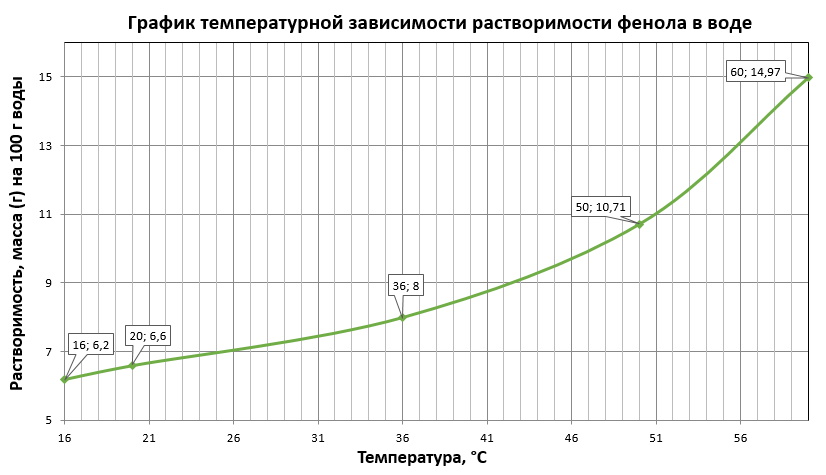
Найдите в Интернете данные о растворимости фенола в воде при различных температурах. Постройте график температурной зависимости растворимости фенола в воде.
В справочнике химика нашли, що 1 г кристаллического фенола растворяется в 15 г воды при 20 0 С, поэтому в 100 г воды при 20 0 С растворится 6,6 г фенола, следовательно первая координата (20;6,6). Остальные координаты берем из других справочников в интернете: (16;6,2); (36;8); (50;10,71); (60;14,97).
Построили график температурной зависимости растворимости фенола в воде:
http://gomolog.ru/reshebniki/10-klass/gabrielyan-drofa-2019/10/5.html
http://gdz.cool/h10_gos_2019/842-h10_gos_2019_13.html