Выражения молекулярных и ионно-молекулярных уравнений реакций
Задача 584.
Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ:
a) NaHCO3 + HCl ⇔;
б) FeCl3 + 3KOH ⇔;
в) Pb(CH3COO)2 + Na2S ⇔;
г) 2КHS + H2SO4 ⇔;
д) Zn(NO3)2 + 2KOH ⇔;
е) Са(ОН)2 + СО2⇔;
ж) Са(ОН)2 + СО2(избыток) ⇔.
Для каждого случая указать причину смещения равновесия в сторону прямой реакции.
Решение:
a) NaHCO3 + HCl ⇔ NaCl + H2O + CO2↑;
HCO3 — + H + ⇔ H2O + CO2↑.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется неустойчивая угольная кислота, которая в водных растворах распадается на углекислый газ и воду:
б) FeCl3 + 3KOH ⇔ Fe(OH)3↓ + 3H2O;
Fe 3+ + 3OH — ⇔ Fe(OH)3↓.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество Fe(OH)3.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество PbS.
Равновесие системы смещено в сторону образования малодиссциируемого электролита H2S.
В результате реакции образуется малорастворимое вещество гидроксид цинка, поэтому равновесие системы сместится вправо.
Равновесие реакции смещено вправо, потому что образуется малорастворимое вещество карбонат кальция.
2ОН — +2СО 2– ⇔ НСО3 — .
При избытке углекислого газа карбонат кальция превращается в гидрокарбонат кальция. В данной реакции при избытке углекислого газа в растворе происходит реакция:
Хотя при данном процессе образуется электролит, но равновесие реакции всё же смещено вправо, потому что согласно принципу Ле Шателье, равновесие системы при избытке углекислого газа будет смещено в сторону уменьшения его концентрации, действительно при постоянном подведении углекислого газа в систему осадка не образуется.
Задача 585.
Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, CH3COONH4, CaCl2, NaClO4, HCOOK, KBr? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию ее водного раствора.
Решение:
a) NaCN — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
CN — + H2O ⇔ HCN + OH — .
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
б) KNO3 — соль сильного основания и сильной кислоты, поэтому гидролизу не подвергается. рР = 7, реакция среды нейтральная.
в) KOCl — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
ClO — + H2O ⇔ HOCl + OH —
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
г) NaNO2 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
д) CH3COONH4 — соль слабого основания и слабой кислоты, поэтому гидролиз протекает как по катиону, так и по аниону:
Так как K(NH4OH) ()= K(CH3COOH) = 1.8 . 10 -5 , то гидролиз соли равномерно протекает как по катиону, так и по аниону, т.е. содержание ионов H+ и OH- примерно одинаково, поэтому рН ((= 7. Реакция среды нейтральная.
е) CaCl2, NaClO4 и KBr являются солями сильных оснований и сильных кислот, поэтому гидролиз этих солей не протекает и, реакция их растворов будет нейтральной, рН = 7.
ж) HCOOK — соль сильного основания и слабой кислоты, поэтому гидролиз соли протекает по аниону:
HCOO — + H2O ⇔ HCOOH + OH —
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
Гидролиз солей слабых оснований и слабых кислот.
В этом случае в реакции одновременно участвуют и катион, и анион соли, связывающие ионы OH — и H + из воды.
В качестве примера рассмотрим гидролиз соли CH3COONH4.Уравнение диссоциации соли:
Краткое ионное и молекулярное уравнения реакции гидролиза:
Значение рН растворов таких солей зависит от относительной силы кислоты и основания, образующих соль. Константы диссоциации уксусной кислоты и гидроксида аммония равны: 
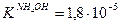
если 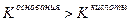
если 
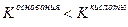
если 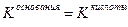
Соли многоосновных слабых кислот и многокислотных слабых оснований гидролизованы в растворе полностью, с образованием кислоты и основания:
Такие соли в водных растворах существовать не могут.
Напишите уравнения гидролиза соли nh4ch3coo
Ответ:
Ацетат аммония (CH3COONH4) — является средней солью, образованной слабым основанием (NH4OH) и слабой кислотой (CH3COOH) ⇒ гидролизуется по катиону и аниону. Характер среды — нейтральный.
CH3COONH4 + H2O ⇄ NH4OH + CH3COOH
NH4⁺ +H2O ⇄ NH4OH + H⁺ (по катиону)
CH3COO⁻ + H2O ⇄ CH3COOH + OH⁻ (по аниону)
CH3COONH4 ⇄ NH4⁺ + CH3COO⁻
Сульфид натрия (Na2S) — является средней солью, образованной сильным основанием (NaOH) и слабой кислотой (H2S) ⇒ гидролизуется по аниону. Характер среды — щелочной.
http://helpiks.org/4-60635.html
http://megamozg.com/task/12981352
