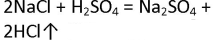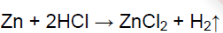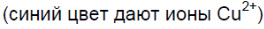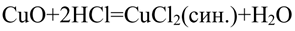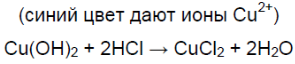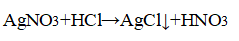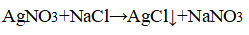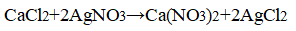Практическая работа 3. Получение соляной кислоты и изучение ее свойств.
Получение соляной кислоты
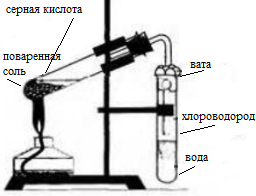
Соберите прибор, как показано на рисунке 13 (см. с. 56).
В пробирку насыпьте 2-3 г поваренной соли и прилейте концентрированную серную кислоту (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5-1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5-6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой!
Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании.
Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз?
Почему конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды?
Химические свойства соляной кислоты
Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвёртую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II), в шестую — немного мела или другого карбоната.
Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой – выделение газа? Составьте уравнения соответствующих реакций.
Распознавание соляной кислоты и её солей
В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)?
Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Получение соляной кислоты
Реакция протекающая между концентрированной серной кислотой и хлоридом натрия при обычных условиях:
NaCl + H2SO4 ⇄ NaHSO4 + HCl
Реакция протекающая между концентрированной серной кислотой и хлоридом натрия при сильном нагревании:
2NaCl + H2SO4 t ⟶ Na2SO4 + 2HCl↑
Появление струек вызвано растворением хлороводорода в воде, образовавшаяся соляная кислота плотнее воды, поэтому она опускается на дно пробирки.
Конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды, для того, чтобы не засосало воду в пробирку, где хлорид натрия реагирует с серной кислотой.
Химические свойства соляной кислоты
Соляная кислота окрашивает лакмусовую бумагу в красный цвет.
Соляная кислота реагирует с цинком, наблюдается выделение газа:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Соляная кислота реагирует с магнием, наблюдается выделение газа:
Mg + 2HCl ⟶ MgCl2 + H2↑
Соляная кислота не реагирует с медью, т. к. в ряду напряжений металлов медь стоит после водорода.
Соляная кислота реагирует с оксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu 2+ ):
CuO + 2HCl t ⟶ CuCl2 + H2O
Соляная кислота реагирует с гидроксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu 2+ ):
Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O
Соляная кислота реагирует с мелом, наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
Распознавание соляной кислоты и её солей
При добавлении нитрата серебра (I) в пробирки с растворами хлороводорода, хлорида натрия и хлорида кальция, наблюдается выпадение белого творожистого осадка:
HCl + AgNO3 ⟶ HNO3 + AgCl↓
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
CaCl2 + 2AgNO3 ⟶ Ca(NO3)2 + 2AgCl↓
Выпавшие осадки растворяются в концентрированной азотной кислоте.
а) Соляную кислоту от других кислот можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
б) Хлориды от других солей можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
в) Растворы хлоридов от соляной кислоты можно с помощью лакмуса, в соляной кислоте он окрасится в красный цвет.
Вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II) потому, что он с галогенидами тоже образует нерастворимое соединение – хлорид свинца (II).
Реактивом на соляную кислоту и её соли является нитрат серебра (I) или нитрат свинца (II).
Практическая работа № 5(c). Получение соляной кислоты и изучение ее свойств
Получение соляной кислоты
Соберите прибор, как показано на рисунке 49.
В пробирку насыпьте 2—3 г хлорида натрия и прилейте столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды. Затем смесь в первой пробирке осторожно нагревайте в течение 5—6 мин (следите, чтобы кислоту не перебросило во вторую пробирку с водой!).
1. Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
2. Чем вызвано появление во второй пробирке тонких опускающихся вниз струек?
3. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Изучение свойств соляной кислоты
Полученную соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумажку. Во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку внесите немного оксида меди(П) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди(П), в шестую — немного мела или другого карбоната.
1. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составьте уравнения соответствующих реакций.
3. Проведите реакции по распознаванию соляной кислоты и ее солей. Для этого в одну пробирку налейте 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения проведенных вами реакций и укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра(1) можно также использовать раствор нитрата свинца(П)?
Ответы:
Получение соляной кислоты (HCl):
Изучение свойств соляной кислоты:
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций.

задача №5
к главе «Практические работы».
Вопросы к параграфу 16 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 16. Практическая работа №3.
Получение соляной кислоты и изучение её свойств
1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Получение соляной кислоты
Насыпали 2-3 г. поваренной соли и прилили концентрированную кислоту (2:1). Закрыли пробирку пробкой с газоотводной трубкой, конец трубки опустили в пробирку с водой, чтобы он находился над уровнем воды на 1 см. нагрели смесь с помощью спиртовки.
Появление в пробирке с водой тонких струек объясняются выделяющимся хлороводородом. Конец газоотводной трубки надо выставить на расстоянии 0,5 см, чтобы воду не засосало в пробирку с серной кислотой, иначе произойдёт взрыв и пробирка лопнет.
В лаборатории соляную кислоту можно получить с помощью растворения в воде хлороводорода, который получают воздействием концентрированной H2SO4 на хлорид.
2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
Химические свойства соляной кислоты
Лакмусовая бумажка окрашивается в красный цвет.
Есть кислотные свойства.
Выделяется бесцветный газ
Zn или Mg стоят левее водорода в ряду напряжений, поэтому реагируют с соляной кислотой с выделением водорода.
Изменений не происходит
Медь стоит правее водорода в ряду напряжений, поэтому реакция не идёт.
Чёрный порошок растворяется, образуется раствор синего цвета.
Реагирует с основными оксидами.
Синий осадок растворяется, образуется раствор синего цвета.
Реагирует с нерастворимыми основаниями.
Выделяется бесцветный газ.
Реагирует с солями слабых кислот
3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Распознавание соляной кислоты её солей
Прилили раствор нитрата серебра
Взаимодействие с нитратом серебра является качественной реакцией на хлорид-ионы.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Отличить а) и б) можно, применяя раствор нитрата серебра (I), потому что образовывается нерастворимый в концентрированной азотной кислоте белый осадок — хлорид серебра (I).
в) применить индикатор и щёлочь, при этом изменится цвет индикатора из кислотной среды в нейтральную в случае соляной кислоты.
Заменить раствор серебра (I) нитратом свинца можно, потому что идёт такая же качественная реакция с образованием белого осадка, но он растворяется в азотной кислоте.
http://5terka.com/node/10692
http://gdzwow.com/answers/9-himiya-uch-rudzitis-vopr-k-par-16.html