Реакция Фриделя — Крафтса. Органическая химия
При получении в промышленности разного вида алкилбензолов и ацилбензолов широкое распространение получила реакция Фриделя‒Крафтса. Она является одним из двух известных способов синтеза данных соединений, а ее параметры подвергаются регулированию для достижения более высокого выхода продукта.
Подробнее о способах алкилирования аренов
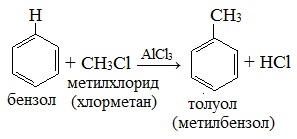
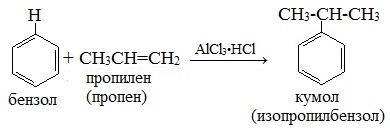
Самым известным примером реакции Фриделя‒Крафтса является взаимодействие хлористого метила (CH3Cl) с бензолом (C6H6) в присутствии хлористого алюминия (AlCl3), где на выходе получают толуол (C7H9). Эту реакцию получили в 1877 г. двое ученых — Чарльз Фридель и Джеймс Крафтс. Она впоследствии стала одной из важных составляющих для промышленного производства алкиларенов.
Основным синтезом является взаимодействие бензола и его гомологов с любыми алкилгалогенидами в присутствии так называемых кислот Льюиса. Суть от изменения реагентов не меняется: реакция всегда проходит по одному и тому же принципу. Производными данного способа стало получение в органической химии алкилбензолов путем взаимодействия спирта и неорганической кислоты, карбониевого иона и ароматического кольца.
Вторым способом считают метод превращения боковой цепи различных ароматических кетонов в присутствии амальгамы цинка (ZnHg) с соляной кислотой (HCl) или гидразина (N2H2) с сильным основанием. Обе реакции носят восстановительный характер: первая называется реакцией по Клемменсу, вторая – по Кижнеру‒Вольфу.
Также если в боковой цепи находятся ненасыщенные связи, их можно восстановить путем реакции на никелевом катализаторе (Ni) в присутствии газообразного водорода (H2).
Механизмы реакции
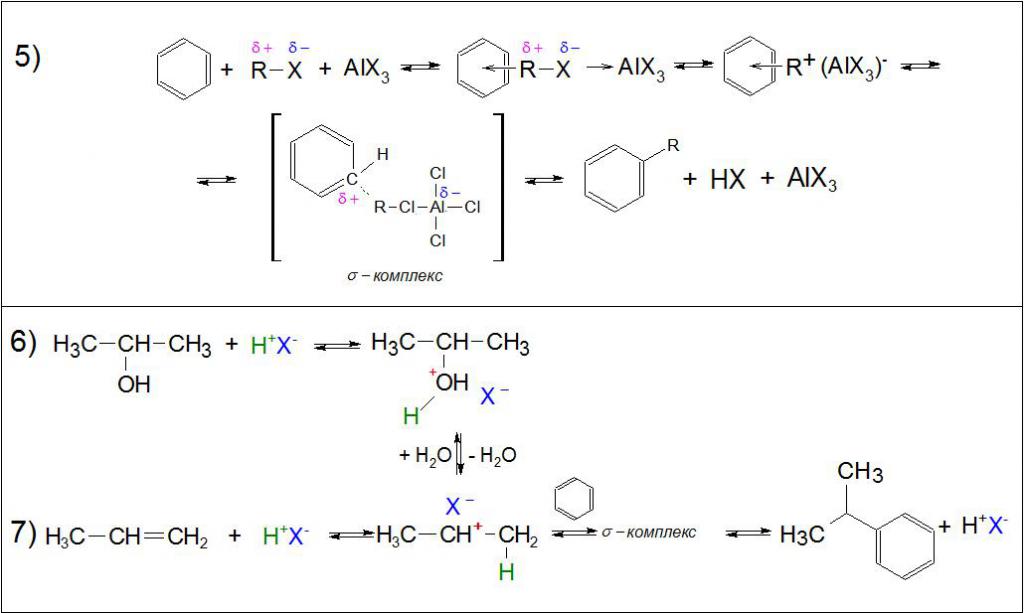
В литературе описывают два возможных пути протекания реакции, и оба они проходят по принципу электрофильного замещения. Разница заключается лишь в природе электрофила: в первом случае это алкильный карбониевый ион (другое название – карбокатион), образующийся в результате присоединения галоген-иона к кислоте Льюиса по донорно-акцепторному принципу, а во втором – одностадийное создание внутреннего комплекса между всеми участвующими реагентами по тому же способу. Ниже подробно рассмотрены каждый из возможных вариантов.
Реакция с образованием карбониевого иона
Данный механизм предполагает прохождение синтеза в 3 стадии, где кислоты Льюиса, например AlCl3, TiCl4, SnCl4, FeCl3, BF3, HF выступают в качестве катализатора процесса.
Для рассмотрения типичной реакции Фриделя-Крафтса было выбрано взаимодействие между бензолом и 1-фторпропаном (C3H6F) в присутствии трехфтористого бора BF3 как катализатора.
В первой стадии процесса C3H6‒F реагирует с BF3, присоединяя галоген-ион по донорно-акцепторному принципу. На внешнем энергетическом уровне у бора есть свободная ячейка (акцептор), которую занимает фтор с неподеленной парой электронов (донор). Благодаря такому присоединению атом углерода C, стоящий рядом с галогеном F в 1-фторпропане, приобретает положительный заряд и становится очень реакционноспособным пропил-карбониевым ионом. Это свойство данных ионов увеличивается в ряду первичный→ вторичный→ третичный, поэтому в зависимости от условий в продуктах реакции алкилирования возможна перегруппировка боковой цепи в более выгодное положение.
Далее, полученный карбокатион реагирует с бензолом и присоединяется в месте связи атомов углерода и водорода, передавая электронную плотность на C ароматического кольца.
В третьей стадии образовавшаяся частица реагирует с ионизированной кислотой Льюиса, где атом H отщепляется от арена и присоединяется к оторвавшемуся F с образованием фтороводорода HF, а продуктами реакции становится н-пропилбензол, изопропилбензол и восстановленный BF3.
Синтез с образованием внутреннего комплекса
Механизм реакции предполагает образование промежуточного общего комплекса, где в одну стадию алкильная группа перемещается от галогена к ароматическому кольцу, а галоген к кислоте Льюиса, создавая при этом ионную пару, которая распадается на алкилбензол, минеральное соединение и восстановленный катализатор.
Виды производных реакций
Реакция Фриделя‒Крафтса для бензола и его гомологов со спиртами в присутствии минеральных кислот проходит по тем же механизмам. В этом случае атом водорода присоединяется к гидроксид-иону и, отрываясь, образует молекулу воды. Образовавшийся карбониевый ион прикрепляется к углероду в ароматическом кольце по месту связи с H. Этот атом отщепляется, присоединяясь к кислотному остатку, а в результате синтезируется алкилбензол.
В ненасыщенных углеводородах по месту двойной связи встает оторвавшийся водород, образуя все тот же карбокатион, связанный с кислотным остатком. Гидрирование алкена проходит возле того атома углерода, который образует наиболее выгодную структуру. Затем реакция проходит как в предыдущем случае.
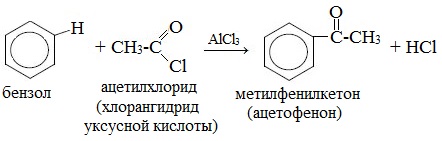
Одним из производных синтезов также является реакция ацилирования по Фриделю-Крафтсу, где вместо алкилгалогенидов используются хлорангидриды (RCOCl) с образованием ароматических кетонов.
Присоединение двух и более алкильных остатков
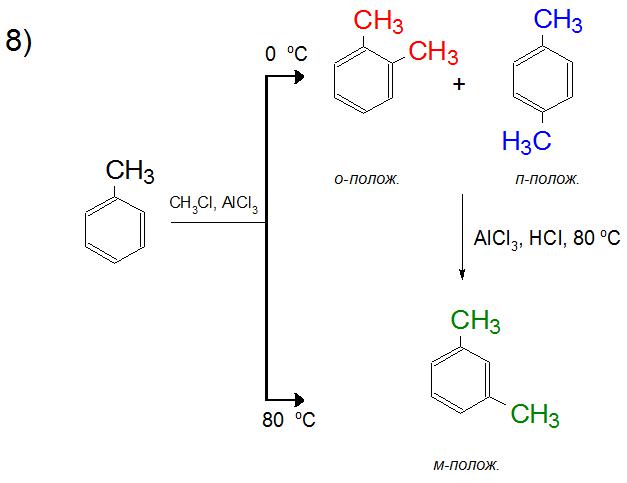
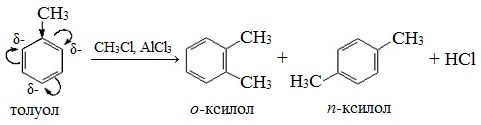
Бензол в реакции Фриделя-Крафтса может присоединять от 2 до 6 заместителей. Стоит отметить, что с каждым разом взаимодействие проходит быстрее, так как связь в ароматическом кольце ослабляется уже при первом синтезе. Процесс образования полиалкилбензолов может осуществляться в ходе одной реакции, поэтому для контроля получения необходимого продукта пользуются избытком ароматического соединения. С помощью этого способа можно постепенно вводить по одной группе в структуру бензола и его гомологов.
В реакции Фриделя-Крафтса толуол легко присоединяет следующую алкильную группу, так как арен уже был активирован по отношению к электрофильному замещению. В продуктах реакции при 0 °C будет равновесная смесь орто- и пара-ксилола, а при повышении температуры до 80 °C синтезироваться будет, в основном, только мета-соединение. Это объясняется, как будет описано ниже, энергетической выгодой образования тех или иных положений в зависимости от нагревания смеси.
Продолжением данного синтеза является возможная способность полигалогеналканов присоединять более одного ароматического кольца по основному механизму.
Особенности синтеза
В органической химии образование смеси изомеров алкилбензолов объясняется двумя причинами. Во-первых, как было сказано выше, образование карбокатиона иногда предполагает более выгодную перегруппировку, за счет чего и образовываются различные структуры продукта. Во-вторых, их количественный состав регулируется температурным режимом (от 0 °C до 80 °C), то есть при повышении температуры с целью компенсации энергозатратности образования конкретной структуры можно добиться более высокого выхода одного из изомеров. Этот же принцип действует и при образовании диалкилбензолов, где орто- и пара-положения при повышении температуры уступают мета-ориентации.
Ограничения в применении синтеза
Существуют 3 нюанса, из-за которых реакция Фриделя‒Крафтса может идти с побочными эффектами или же не идти вовсе.
Ввод электродефицитных заместителей в ароматическое кольцо сопровождается дезактивацией арена по отношению к дальнейшим реакциям замещения. Так, например, при присоединении иона нитрония к алкилбензолам синтез проходит труднее, так как он оттягивает электронную плотность на себя из-за стремления азота заполнить пустую ячейку на внешнем энергетическом уровне. Из этих же соображений, полинитрование или, например, полисульфирование проходит при очень жестких условиях, так как с каждым последующим синтезом ароматическое кольцо теряет реакционную способность.
Поэтому синтез по Фриделю-Крафтсу не идет, если в ароматическом кольце есть электродефицитные заместители, в особенности, имеющие сильноосновные свойства, связывающие кислоты Льюиса (например -NH2, –NHR, -NR2). А вот реакции, например, с галогенбензолами или ароматическими карбоновыми кислотами идут по типичному механизму, хотя они и обладают меньшей реакционной способностью.
Важным моментом также является перегруппировка карбониевого иона в процессе или же продукта в конце, так как на нее оказывает большое влияние условия проведения синтеза, в частности, температура и избыток алкилируемого вещества.
Вместо алкилгалогенидов R‒X (R = алкильная группа, X = галоген) нельзя использовать галогенарены Ar‒X (Ar = ароматическое соединение), так как они очень тяжело вступают в реакцию отщепления заместителя даже под влиянием кислот Льюиса.
Напишите уравнения реакции фриделя крафтса
Реакция Фриделя-Крафтса – алкилирование или ацилирование ароматических соединений в присутствии катализаторов кислотного характера (AlCl3, AlBr3, BF3, ZnCl2, FeBr3, FeCI3).
Алкилирование
Алкилирование – введение в бензольное кольцо алкильного радикала (-СН3, -С2Н5, -С3Н7 и др.) путем замещения атома водорода.
а) Введение в бензольное кольцо алкильной группы с помощью алкилгалогенида (галогеналкана) в пристустивии катализаторов (алкилирование по Фриделю-Крафтсу). В результате реакции образуются гомологи бензола.
В свою очередь гомологи бензола также могут вступать в реакцию Фриделя-Крафтса.
б) Алкилирование бензола происходит также при его взаимодействии с алкенами в присутствии кислотных катализаторов (алкилирование алкенами).
Ацилирование
Ацилирование — введение в бензольное кольцо ацильной группы (ацила) -CR=O с помощью ацилгалогенида путем замещения атома водорода.
В качестве ацилирующих веществ используют хлорангидриды карбоновых кислот (ацилхлориды) R-CO-Cl. В результате реакции образуются ароматические кетоны.
Реакция была осуществлена впервые в 1877 г. французским химиком Ш. Фриделем и американцем Д. Крафтсом.
Напишите уравнения реакции фриделя крафтса
Вопрос по химии:
Напишите уравнения реакций получения этилбензола с помощью реакции Фриделя — Крафтса и окисления этилбензола подкисленным раствором КМnО4.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
C6H6+CH3-CH2Cl->C6H5-CH2-CH3 + HCl-р. Фриделя-Крафтса
5C6H5-CH2-CH3+12KMnO4+18H2SO4->
5C6H5-COOH + 5CO2+6K2SO4+12MnSO4+28H2O
C(-2)-5e -> C(+3)
C(-3) -7e -> C(+4)
Mn(+7)+5e -> Mn(+2)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://himija-online.ru/imennye-reakcii/reakciya-fridelya-kraftsa.html
http://online-otvet.ru/himia/5cea885996f4e19a2925ac39