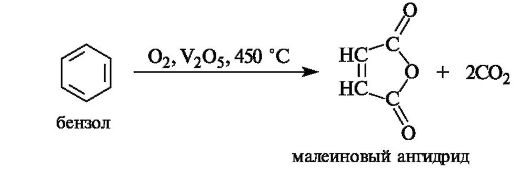
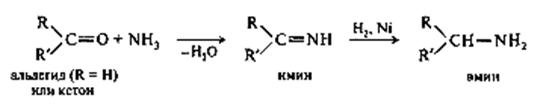
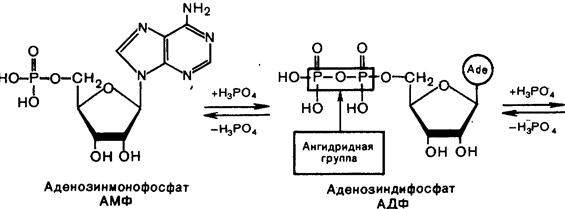
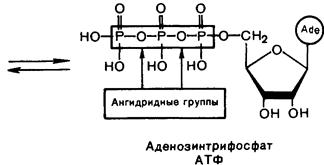
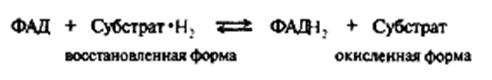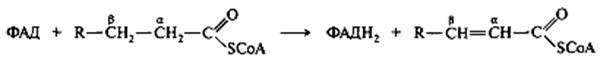Билет №16
Читайте также:
|
 |  |


L-2-аминобутандиовая кислота D-2-аминобутандиовая кислота
4. Образование каких соединений возможно при нагревании этанольного раствора D-галактозы в присутствии HCl? Приведите уравнения реакций.


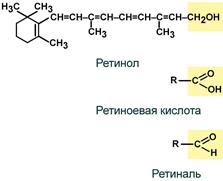
Витамин А (ретинол, антиксерофтальмический)
Источники
С пищевыми продуктами в организм поступает как витамин А , так и каротиноиды – вещества, схожие с ним по строению.
- витамин А содержат рыбий жир, печень морских рыб, печень крупного рогатого скота и свиньи, жирномолочные продукты (сливочное масло, сливки, сметана), желток яиц,
- каротиноиды имеются в красных овощах (морковь, красный перец, томаты), в пальмовом и в облепиховом масле.
Суточная потребность
Потребность в витамине может измеряться как миллиграммах, так и в международных единицах (МЕ) – 1,0 мг витамина А соответствует 3300 МЕ.
Физиологическая потребность для детей и взрослых составляет 1,5-2,5 мг (5000-8250 МЕ) в зависимости от возраста и физических нагрузок.
Метаболизм
Всасывается только 1/6 часть потребленных каротиноидов. После всасывания некоторые каротиноиды в кишечнике превращаются в ретинол, при этом из β-каротина образуется 2 молекулы витамина А.
Строение
Ретиноиды представляют собой β-иононовое кольцо с метильными заместителями и изопреновой цепью. В организме спиртовая группа ретинола окисляется в свои активные формы: альдегидную (ретиналь) или карбоксильную (ретиноевая кислота) группы.
Строение витамина А и его активных форм
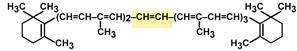
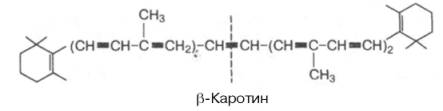
Строение β-каротина
Биохимические функции
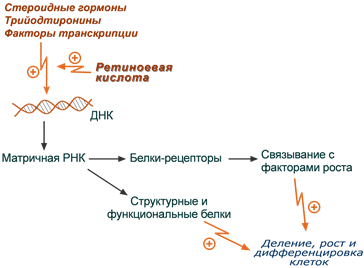
1. Регуляция экспрессии генов
Ретиноевая кислота служит лигандом для суперсемейства ядерных рецепторов, к числу которых относятся рецепторы к стероидным гормонам (кортизол, тестостерон), к витамину D, трийодтиронину, простагландинам, к транскрипционным факторам. Таким образом, она абсолютно необходима для экспрессии генов, участвующих в процессах развития клетки и обеспечивающих чувствительность клеток к гормонам и ростовым стимулам. Благодаря такой функции ретиноевая кислота:
- регулирует нормальный рост и дифференцировку клеток эмбриона и молодого организма,
- стимулирует деление и дифференцировку клеток быстро делящихся тканей – хряща, костной ткани, сперматогенного эпителия, плаценты, эпителия кожи, слизистых оболочек, клеток иммунной системы.
Участие ретиноевой кислоты в дифференцировке,
делении и росте клеток
2. Участие в фотохимическом акте зрения
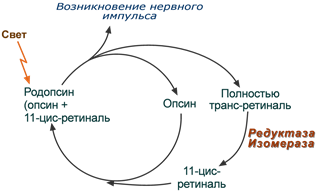
Ретиналь в комплексе с белком опсином формирует зрительный пигмент, который находится в клетках сетчатки глаза – в палочках (черно-белое сумеречное зрение) и в колбочках (дневное цветное зрение). Пигмент палочек обычно именуется родопсином , тогда как в колбочках он именуется йодопсином . В обоих случаях пигмент представляет собой семидоменный белок опсин и хромофор – ретиналь .
Участие ретинола в фотохимическом акте зрения
При попадании фотона света на молекулу родопсина последний распадается на опсин и полностью транс-ретиналь. При этом в мембране генерируется электрический сигнал, идущий в зрительный центр головного мозга. В дальнейшем, под влиянием ферментов, алло-транс-ретиналь превращается в 11-цис-ретиналь и связывается с опсином, снова образуя родопсин.
3. Антиоксидантная функция
Благодаря наличию двойных связей в изопреновой цепи витамин А способен осуществлять нейтрализацию свободных кислородных радикалов, но особенно явно эта функция проявляется у каротиноидов.
Гиповитаминоз А
Причина
Помимо пищевой недостаточности и нарушения желчеотделения, причиной гиповитаминоза А может быть
- недостаточность витаминов Е и С, защищающих ретинол от окисления,
- гипотиреоз(снижение функции щитовидной железы), так как диоксигеназа, превращающая каротиноиды в витамин А, активируется тиреоидными гормонами,
- недостаток железа, входящего в состав диоксигеназы, и цинка, требуемого для белка, обеспечивающего всасывание витамина.
Клиническая картина
1. Стерильность – желтое тело беременности накапливает каротиноиды β-каротин и лютеин. Вероятно, они несут антиоксидантную нагрузку, обеспечивая жизнеспособность и нормальное функционирование желтого тела.
2. При сильном гиповитаминозе и авитаминозе происходит снижение синтеза родопсина и нарушение темновой адаптации – куриная слепота;
3. Задержка роста, похудание, истощение;
4. Специфические поражения глаз, слизистых оболочек, кожи:
- кожа – гиперкератоз (пролиферация и патологическое ороговение кожи, сухость и шелушение – т.н. «жабья кожа«) приводит к вторичным гнойным процессам,
- глаза – ороговение эпителия слезного канала ( ксерофтальмия ) приводит к его закупорке. Это порождает, во-первых, сухость роговой оболочки глаза, т.к. нет слезы, во-вторых, влечет за собой воспаление роговой оболочки из-за отсутствия лизоцима (антибактериального фермента слезы). Оба фактора приводят к кератомаляции – отек, изъязвление, размягчение роговой оболочки,
- слизистые оболочки – из-за снижения синтеза гликопротеинов и нарушения барьерной функции слизистых оболочек происходит поражение эпителия желудочно-кишечного тракта, дыхательных путей и мочеполовой системы, также нарушение сперматогенеза.
В бедных развивающихся странах Африки и Азии ксерофтальмия поражает десятки тысяч детей в возрасте от 18 месяцев до 9 лет ежегодно.
В случае с поражением эпителия ЖКТ наблюдается возникновение порочного круга: нехватка витамина А вызывает поражение слизистых ЖКТ, а это провоцирует ухудшение всасывания веществ, в том числе и витамина А.
Поражение дыхательных путей приводит к снижению местного иммунитета, вплоть до ларинготрахеобронхита и пневмонии. Было показано, что коррекция содержания витамина А в диете детей тропических стран снижала смертность от инфекций на 30% !
Гипервитаминоз А
Причина
Избыточный прием витамина А с витаминными препаратами и, реже, с пищей.
Клиническая картина
Острое отравление сопровождается головной болью, тошнотой, слабостью, ступором, отеком соска зрительного нерва (вследствие ликворной гипертензии), может повышаться температура.
При хроническом отравлении нарушается пищеварение, исчезает аппетит, наступает потеря веса тела, снижается активность сальных желез кожи и развивается сухой дерматит, ломкость костей.
У витамина А в высоких дозах имеется нефротоксичность, канцерогенность и эмбриотоксичность.
Лекарственные формы
Ретинолацетат, ретинолпальмитат (в них функциональная ОН-группа защищена жирными кислотами).
ВИТАМИНЫ, РАСТВОРИМЫЕ В ЖИРАХ. Витамины группы А
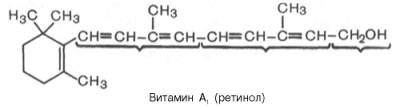
Витамин А (ретинол; антиксерофтальмический витамин) хорошо изучен. Известны три витамина группы А: А1, А2 и цис-форма витамина А1, названная неовитамином А. С химической точки зрения ретинол представляет собой циклический непредельный одноатомный спирт, состоящий из шестичленного кольца (β-ионон), двух остатков изопрена и первичной спиртовой группы.
Витамин А2 отличается от витамина А1 наличием дополнительной двойной связи в кольце β-ионона. Все 3 формы витаминов группы А существуют в виде стереоизомеров, однако только некоторые из них обладают биологической активностью. Витамины группы А хорошо растворимы в жирах и жирорастворителях: бензоле, хлороформе, эфире, ацетоне и др. В организме они легко окисляются при участии специфических ферментов с образованием соответствующих цис- и транс-альдегидов, получивших название ретиненов (ретинали), т.е. альдегидов витамина А; могут откладываться в печени в форме более устойчивых сложных эфиров с уксусной или пальмитиновой кислотой.
Характерными симптомами недостаточности витамина А у человека и животных являются торможение роста, снижение массы тела, общее истощение организма, специфические поражения кожи, слизистых оболочек и глаз. Прежде всего поражается эпителий кожи, что проявляется пролиферацией и патологическим ороговением его; процесс сопровождается развитием фолликулярного гиперкератоза, кожа усиленно шелушится, становится сухой. В результате начинаются вторичные гнойные и гнилостные процессы. При авитаминозе А поражается также эпителий слизистой оболочки всего пищеварительного тракта, мочеполового и дыхательного аппаратов. Характерно поражение глазного яблока – ксеро-фтальмия, т.е. развитие сухости роговой оболочки глаза (от греч. xeros – сухой, ophthalmos – глаз) вследствие закупорки слезного канала, эпителий которого также подвергается ороговению. Глазное яблоко не омывается слезной жидкостью, которая, как известно, обладает бактерицидным свойством. В результате этого развиваются воспаления конъюнктивы, отек, изъязвление и размягчение роговицы. Этот комплекс поражений обозначают термином «кератомаляция» (от греч. keras – рог, malatia – распад); она развивается очень быстро, иногда в течение нескольких часов. Распад и размягчение роговицы связаны с развитием гнойного процесса, поскольку гнилостные микроорганизмы при отсутствии слезной жидкости быстро развиваются на поверхности роговицы.
К наиболее ранним и специфическим симптомам авитаминоза А (гиповитаминоза А) относится куриная, или ночная, слепота (гемералопия). Она выражается в потере остроты зрения, точнее, способности различать предметы в сумерках, хотя больные днем видят нормально.
Помимо гипо- и авитаминозов, описаны случаи гипервитаминоза А при употреблении в пищу печени белого медведя, тюленя, моржа, в которой содержится много свободного витамина А. Характерны проявления гипер-витаминоза А: воспаление глаз, гиперкератоз, выпадение волос, общее истощение организма. При этом, как правило, отмечаются потеря аппетита, головные боли, диспепсические явления (тошнота, рвота), бессонница. Гипервитаминоз может развиться и у детей в результате приема больших количеств рыбьего жира и препаратов витамина А. Описан острый гипер-витаминоз у детей после приема больших доз витамина А, при этом повышается его содержание в крови.
Биологическая роль. Витамин А оказывает влияние на барьерную функцию кожи, слизистых оболочек, проницаемость клеточных мембран и биосинтез их компонентов, в частности определенных гликопротеинов. Действие витамина А в этих случаях связывают с его вероятной причастностью к синтезу белка. Существует предположение, что благодаря наличию двойных связей в молекуле витамин А может участвовать в окислительно-восстановительных реакциях, поскольку он способен образовывать перекиси, которые в свою очередь повышают скорость окисления других соединений.
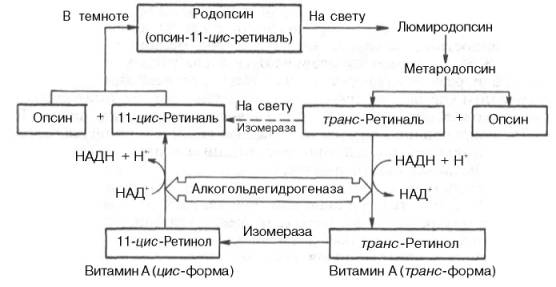
Более подробно выяснено значение витамина А в процессе свето-ощущения. В этом важном физиологическом процессе большую роль играет особый хромолипопротеин – сложный белок родопсин, или зрительный пурпур, являющийся основным светочувствительным пигментом сетчатки, в частности палочек, занимающих ее периферическую часть. Установлено, что родопсин состоит из липопротеина опсина и простети-ческой группы, представленной альдегидом витамина A1(ретиналь); связь между ними осуществляется через альдегидную группу витамина и свободную ε-NH2-группу лизина молекулы белка с образованием шиффова основания. На свету родопсин расщепляется на белок опсин и ретиналь; последний подвергается серии конформационных изменений и превращению в транс-форму. С этими превращениями каким-то образом связана трансформация энергии световых лучей в зрительное возбуждение – процесс, молекулярный механизм которого до сих пор остается загадкой. В темноте происходит обратный процесс – синтез родопсина, требующий наличия активной формы альдегида – 11-цис-ретиналя, который может синтезироваться из цис-ретинола, или транс-ретиналя, или транс-формы витамина А при участии двух специфических ферментов – дегидрогеназы и изомеразы. Более подробно цикл превращений родопсина в сетчатке глаза на свету и в темноте можно представить в виде схемы:
Таким образом, под действием кванта света родопсин через ряд промежуточных продуктов («оранжевый» и «желтый» белки) распадается на опсин и алло-транс-ретиналь, представляющий собой неактивную форму альдегида витамина А. Имеются сведения, что алло-транс-ретиналь может частично превращаться в активный 11-цис-ретиналь под влиянием света (на схеме – пунктирная стрелка). Однако главным путем образования 11-цис-ретиналя является ферментативное превращение транс-формы витамина А в цис-форму (под действием изомеразы) и последующее окисление ее при участии алкогольдегидрогеназы.
Следует отметить, что подобные зрительные циклы имеют место как в палочках, так и в колбочках. Показано, что сетчатка содержит 3 типа клеток-колбочек, каждый из которых наделен одним из трех цветочувстви-тельных пигментов, поглощающих синий, зеленый и красный свет соответственно при 430, 540 и 575 нм. Оказалось, что все 3 пигмента, получившие название иодопсинов, также содержат 11-цис-ретиналь, но различаются по природе опсина (колбочные типы опсина). Некоторые формы цветовой слепоты (дальтонизм) вызваны врожденным отсутствием синтеза одного из 3 типов опсина в колбочках или синтезом дефектного опсина (люди не различают красный или зеленый цвет).
Распространение в природе и суточная потребность. Витамин А широко распространен. Наиболее богаты этим витамином следующие продукты животного происхождения: печень крупного рогатого скота и свиней, яичный желток, цельное молоко, масло, сметана, сливки. Особенно много свободного витамина А в жирах печени морского окуня, трески, палтуса: в частности, в жире печени морского окуня содержание витамина А доходит до 35%. Источниками витамина А для человека являются также красно-мякотные овощи (морковь, томаты, перец и др.), в которых витамин А содержится в виде провитаминов – каротинов, выделенных впервые из моркови (от лат. carota – морковь). Известны 3 типа каротинов: α-, β- и γ-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает β-каротин, поскольку он содержит два β-иононовых кольца и при распаде в организме из него образуются две молекулы витамина А.
При окислительном распаде α- и γ-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному β-иононовому кольцу. Расщепление каротинов на молекулы витамина А происходит преимущественно в кишечнике под действием специфического фермента β-каротин-диоксигеназы (не исключена возможность аналогичного превращения и в печени) в присутствии молекулярного кислорода. При этом образуются 2 молекулы ретиналя, которые под действием специфической кишечной редуктазы восстанавливаются в витамин А. Степень усвоения каротинов и свободного витамина А зависит как от содержания жиров в пище, так и от наличия свободных желчных кислот, являющихся абсолютно необходимыми соединениями для процесса всасывания продуктов распада жиров.
Суточная потребность для взрослого человека составляет в среднем 2,7 мг витамина А или от 2 до 5 мг β-каротина. У человека основным органом, в котором частично откладывается про запас витамин А, является печень. В норме в ней содержится около 20 мг этого витамина на 100 г ткани.
http://biokhimija.ru/vitaminy/vitamin-a.html
http://xumuk.ru/biologhim/082.html