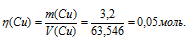Дополнительно о реакциях электролиза
В том случае, когда металл расположен в средней части ряда напряжения (от цинка до водорода) на катоде одновременно протекают два процесса: восстановление катиона металла и восстановление молекул воды. Рассмотрим электролиз водного раствора сульфата никеля с инертными электродами.
В растворе: NiSO4 = Ni 2+ + SO4 2– ;
Эти реакции никак не связаны между собой и суммировать их нельзя! Никакого простого соотношения между количеством никеля и водорода нет, оно зависит от концентрации, температуры, материала катода и прочих факторов.
А(+) (SO4 2– – не окисляются )
Общих уравнений (катод + анод) в этом случае тоже будет два. Чтобы получить общее уравнение основной реакции, мы должны сложить уравнение основного процесса на катоде и уравнение анодного процесса, с учетом коэффициентов электронного баланса:
K(-) Ni 2+ + 2ē = Ni |2
2Ni 2+ + 2H2O = 2Ni + O2 + 4H + – ионное,
2NiSO4 + 2H2O = 2Ni + O2 + 2H2SO4 – молекулярное уравнение основной реакции.
Аналогично получаем общее уравнение побочной реакции:
Опять же, суммировать общие уравнения основной и побочной реакций нельзя! (а это встречается в некоторых пособиях).
В заданиях ЕГЭ вряд ли потребуется составлять общие уравнения реакций для таких случаев, как правило, требуется только написать уравнения отдельных процессов на электродах. Остальное скорее пригодится на олимпиадах.
Немного о расчетах. Если в некоторой задаче дано количество вещества никеля, полученного при электролизе, можно рассчитать, сколько соли подверглось электролизу, сколько серной кислоты образовалось. Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь. Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Если сказано, сколько выделилось кислорода – нельзя рассчитать ничего, кроме общего количества вступившей в реакцию воды.
Вот если сказано, сколько выделилось никеля и сколько кислорода – тогда можно рассчитать все.
Г.М. Можаев
старший преподаватель
ТюмГУ, химический факультет;
ТОГИРРО
Написать уравнение реакции электролиза раствора сульфат никеля?
Химия | 10 — 11 классы
Написать уравнение реакции электролиза раствора сульфат никеля.
NiSO4 + 2H2O = Ni + H2 + H2SO4 + O2.
Напишите уравнения реакций, протекающих при электролизе водного раствора сульфата титана (IV)?
Напишите уравнения реакций, протекающих при электролизе водного раствора сульфата титана (IV).
Написать электронные уравнения реакций, происходящих на электродах при электролизе водного раствора сульфата кадмия : 1?
Написать электронные уравнения реакций, происходящих на электродах при электролизе водного раствора сульфата кадмия : 1.
С инертными электродами 2.
С кадмиевым анодом.
Какой металл способен вытеснить никель из раствора сульфата никеля из раствора сульфата никеля?
Какой металл способен вытеснить никель из раствора сульфата никеля из раствора сульфата никеля?
Написать уравнения реакций, при электролизе в растворах а)бромида лития, б) сульфата калия, в) азотной кислоты?
Написать уравнения реакций, при электролизе в растворах а)бромида лития, б) сульфата калия, в) азотной кислоты.
Составить молекулярные и ионно молекулярные уравнения реакции происходящей в растворе между сероводородом и сульфатом никеля(2)?
Составить молекулярные и ионно молекулярные уравнения реакции происходящей в растворе между сероводородом и сульфатом никеля(2).
Написать реакцию электролиза раствора иодида натрия?
Написать реакцию электролиза раствора иодида натрия.
Написать уравнение реакции натрия с водородом, никель (II) сульфат, азотом?
Написать уравнение реакции натрия с водородом, никель (II) сульфат, азотом.
Назвать полученные соединения.
Составьте уравнение реакции, протекающих на катоде и аноде , и суммарное уравнение электролиза водного раствора сульфата калия?
Составьте уравнение реакции, протекающих на катоде и аноде , и суммарное уравнение электролиза водного раствора сульфата калия.
Написать электронные уравнения реакций, протекающих на угольных электродах при электролизе водных растворов : а) Йодида Калия ; б)Хлорида олова (II) ; в)сульфата марганца(II)?
Написать электронные уравнения реакций, протекающих на угольных электродах при электролизе водных растворов : а) Йодида Калия ; б)Хлорида олова (II) ; в)сульфата марганца(II).
Написать электрическое уравнение электролиза раствора сульфат никеля?
Написать электрическое уравнение электролиза раствора сульфат никеля?
Перед вами страница с вопросом Написать уравнение реакции электролиза раствора сульфат никеля?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
Какие процессы протекают на электродах при электролизе солей серной кислоты
Задача 711.
При электролизе водного раствора сульфата никеля (II) на аноде протекает процесс: 2H2O → O2 + 4H + + 2
Решение:
Стандартный электродный потенциал электрохимической системы Ni → Ni 2+ + 2 
Ni 2+ + 2 
Так как на аноде протекает процесс: 2H2O → O2 + 4H + + 2
Ответ: в).
Задача 712.
При электролизе водного раствора сульфата калия значение рН раствора в приэлектродном пространстве возросло. К какому полюсу источника тока присоединен электрод: а) к положительному; б) к отрицательному?
Решение:
Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов OH — , что приводит к повышению рН раствора. У анода будет идти выделение кислорода и накопление ионов H + , что способствует понижению рН раствора. В то же время в катодное пространство будут приходить ионы К + , а в анодное – ионы SO4 2- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щёлочь, а в анодном – кислота. Поэтому электрод присоединён к отрицательному полюсу источника тока, т.е. является катодом, на котором протекает восстановление воды:
Ответ: б)
Задача 713.
При электролизе водного раствора соли значение рН в приэлектродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу: а) КСI; б) СuCl2; в) Сu(NO3)2?
Решение:
Стандартные электродные потенциалы систем K → K + + 1 

Уравнения электродных процессов:
К(+): 2|4| 2H2O + 2 
А(-): 1|2|2Н2О — 4ē = О2↑ + 4Н +
В случае электролиза солей СuCl2 и Сu(NO3)2, на катоде будет происходить электрохимическое восстановление ионов меди:
Cu 2+ + 2 
Поэтому при электролизе солей малоактивного металла – меди рН раствора в приэлектродном пространстве не будет повышаться.
Ответ: а).
Задача 714.
При электролизе водного раствора NaOН на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде: а) 2,8 л; б) 5,6 л; в) 11,2 л; г) 22,4 л?
Решение:
При электролизе раствора едкого натра на электродах выделяется: водород (катод) и кислород (анод). Электрохимические процессы на электродах при электролизе NaOH:
катодный процесс: 2H2O + 2 
анодный процесс: 4OH — — 4 
Умножив, уравнение катодного процесса на два и сложив его с уравнением анодного процесса, получим суммарное уравнение процесса:
Из суммарного уравнения электролиза NaOH вытекает, что при электролизе щёлочи выделяется в два раза большее количество водорода, чем кислорода. Поэтому, если на аноде выделилось 2,8 л кислород, то на катоде в два раза больше выделится водорода: 2,8 . 2 = 5,6 л.
Ответ: б).
Задача 715.
При электролизе раствора CuCl2 масса катода увеличилась на 3,2 г. Что произошло при этом на медном аноде: а) выделилось 0,112 л С12 б) выделилось 0,56 л О2; в) перешло в раствор 0,1 моля Сu 2+ ; г) перешло в раствор 0,05
моля Cu 2+ ?
Решение:
При электролизе раствора соли CuCl2 с медным анодом, последний будет окисляться в ходе электролиза, переходить в раствор в виде катионов Cu 2+ и «переосаждаться» на катоде. Следовательно, будет наблюдаться перенос меди с анода на катод. Таким образом, если масса катода увеличилась на 3,2 г, то на аноде такое же количество меди перешло в раствор.
Рассчитаем количество меди:
http://himia.my-dict.ru/q/3860088_napisat-uravnenie-reakcii-elektroliza-rastvora-sulfat/
http://buzani.ru/zadachi/khimiya-glinka/1244-okislenie-sulfata-zheleza-ii-v-kisloj-srede-zadachi-646-649