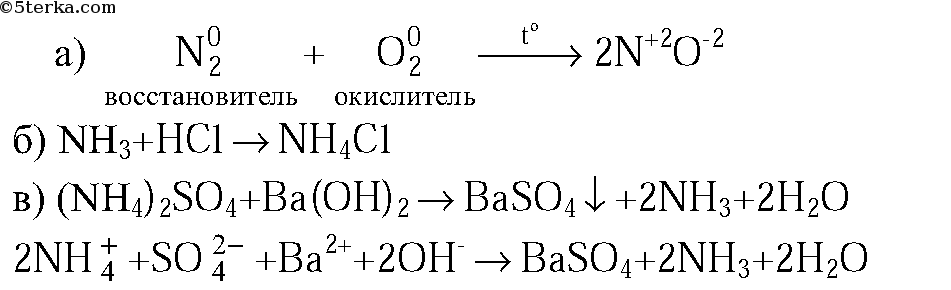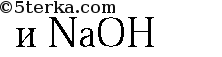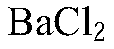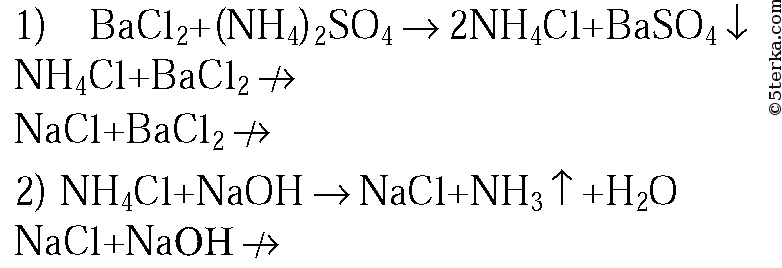Вариант 4
Вопросы:
1. Напишите уравнения реакций: а) азота с кислородом (укажите условия протекания, обозначьте степени окисления элементов и укажите окислитель и восстановитель); б) аммиака с хлороводородом; в) раствора сульфата аммония с раствором гидроксида бария (в молекулярной и ионной формах).
2. В трех пронумерованных пробирках находятся кристаллические вещества: хлорид аммония, сульфат аммония и хлорид натрия. Как их можно распознать? Напишите уравнения соответствующих реакций.
3. Изобразите молекулярную, электронную и структурную формулы аммиака. Перечислите физические свойства аммиака.
Ответы и решения:
2. Данные вещества можно распознать при помощи растворов

задача №4
к главе «Тема III. Подгруппа азота. Работа 1. Азот. Аммиак. Соли аммония».
Напишите уравнения реакций: а) азота с кислородом (укажите условия протекания, обозначьте степени окисления элементов и укажите окислитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
1. Определите степени окисления азота и тип химической связи в веществах: N2, NH3, N2O5, Са3N2.
2. Напишите уравнения реакций азота с кислородом и барием. Приведите электронный баланс.
3. Напишите уравнения реакций аммиака с бромоводородной кислотой и кислородом в отсутствие катализатора.
4*. Какой объем (н. у.) аммиака может быть получен из 42,8 г хлорида аммония, если выход реакции составляет 90% от теоретически возможного?
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
1. Определите степени окисления азота и тип химической связи в веществах: NF3, NO, Na3N, N2H4.
2. Напишите уравнения реакций азота с натрием и водородом. Приведите электронный баланс.
3. Напишите уравнения реакций аммиака с соляной кислотой и кислородом в присутствии катализатора.
4*. Какой объем аммиака (н. у.) может быть получен из 1,12 м азота, если выход реакции составляет 50% от теоретически возможного?
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
1. Определите степени окисления азота и тип химической связи в веществах: HNO3, NO2, NH4NO2, Ва3N2.
2. Напишите уравнения реакций азота с магнием и литием. Приведите электронный баланс.
3. Напишите уравнения реакций аммиака с фосфорной кислотой и оксидом меди (II).
4*. Какой объем оксида азота (II) может быть получен из 20 л аммиака (н. у.), если выход реакции составляет 80% от теоретически возможного?
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
1. Определите степени окисления азота и тип химической связи в веществах: HNO2, N2O3, (NH4)2 SO4, Na3N.
2. Напишите уравнения реакций получения азота с кальцием и фтором. Приведите электронный баланс.
3. Напишите уравнения реакций аммиака с серной кислотой и водой.
4*. Определите объем аммиака, который может быть получен из 560 л азота (н. у.), если выход аммиака составляет 60% от теоретически возможного.
Проверочная работа «Азот и его свойства. Аммиак и его свойства»
1) N2 — степень окисления 0, тип химической связи — ковалентная неполярная, NH3 — степень окисления -3, тип химической связи — ковалентная полярная, N2O5 — степень окисления +5, тип химической связи — ковалентная полярная, Ca3N2 — степень окисления -3, тип химической связи — ионная.
2) N2 + O2 = 2NO; N2 + 3Ва = Ba3N2.
3) NH3 + HBr = NH4Br; 4NH3 + 3O2 = 2N2 + 6H2O.
1) NF3 — степень окисления +3, тип химической связи — ковалентная полярная, NO — степень окисления +2, тип химической связи — ковалентная полярная, Na3N — степень окисления -3, тип химической связи — ионная, N2H4 — степень окисления -2, тип химической связи — ковалентная неполярная между атомами азота и ковалентная полярная между азотом и водородом.
2) N2 + 6Na — 2Na3N; N2 + 3H2(Fe, t°, P) ↔ 2NH3.
3) NH3 + HC1 — NH4C1; 4NH3 + 5O2(Pt) = 4NO + 6H2O.
1) HNO3 — степень окисления 5, тип химической связи — ковалентная полярная, NO2 — степень окисления -4, тип химической связи — ковалентная полярная, NH4NO2 — степень окисления -3 и +3, тип химической связи — ковалентная полярная в ионе аммония и кислотном остатке, ионная между катионом и анионом, Ba3N2 — степень окисления -3, тип химической — связи ионная.
2) N2 + 3Mg = Mg3N2; N2 + 6Li = 2Li3N.
3) NH3 + H3PO4 = NH4H2PO4 или 2NH3 + H3PO4 = (NH4)2HPO4;
2NH3 + 3CuO = 3Cu + 3H2O + N2.
1) HNO2 — степень окисления +3, тип химической связи — ковалентная полярная, N2O3 — степень окисления +3, тип химической связи — ковалентная полярная, (NH4)2SO4 — степень окисления -3, тип химической связи — ковалентная полярная в ионе аммония и кислотном остатке, ионная между катионом и анионом, Na3N — степень окисления -3, тип химической связи — ионная.
2) 3Са + N2 = Ca3N2; N2 + 3F2 = 2NF3.
3) NH3 + H2O ↔ NH3•H20; 2NH3 + H2SO4 = (NH4)2SO4.
http://www.soloby.ru/468918/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4%D0%BE%D0%BC-%D0%BF%D1%80%D0%BE%D1%82%D0%B5%D0%BA%D0%B0%D0%BD%D0%B8%D1%8F-%D0%BE%D0%B1%D0%BE%D0%B7%D0%BD%D0%B0%D1%87%D1%8C%D1%82%D0%B5-%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C
http://pandia.org/text/82/480/72833.php