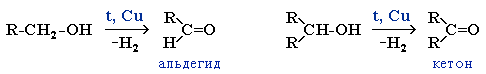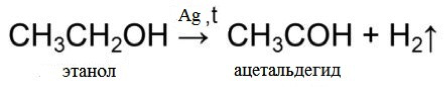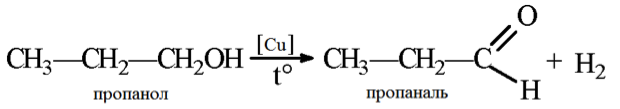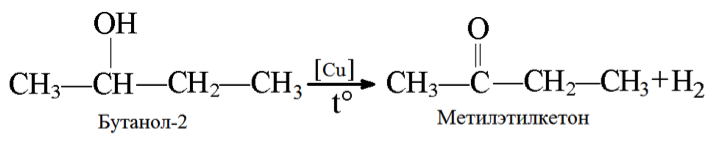Каталитическое дегидрирование спиртов
Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 — 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al2O3, SnO2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.
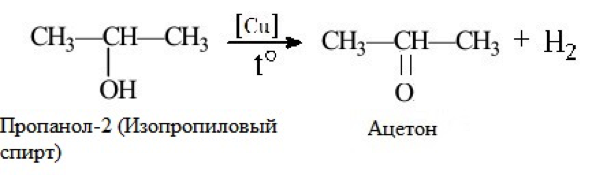
2. Дегидрирование пропанола может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 — 450 °С.
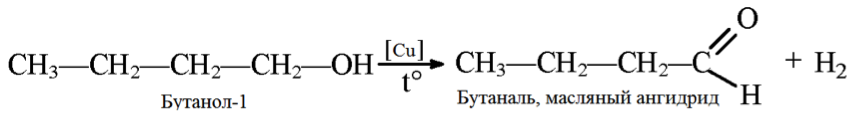
3. Дегидрирование бутанола так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).
4. Дегидрирование метанола. Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 — 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.
webHimik
подробное решение задач по химии
Составьте уравнения реакции спиртов пропанол-1 и пропанол-2
Составьте следующие уравнения реакции спиртов пропанол-1 и пропанол-2:
- окисление
- с натрием металлическим
- с уксусной кислотой
- внутримолекулярная дегидратация
- межмолекулярная дегидратация
Решение:
Окисление спиртов пропанол-1 и пропанол-2
Окисление первичных спиртов приводит к образованию молекул альдегидов, а вторичных – кетонов. Соответственно первичный спирт пропанол-1 окисляется до альдегида, а вторичный спирт пропанол-2 окисляется до кетона.

Взаимодействие спиртов пропанол-1 и пропанол-2 с металлическим натрием
Спирты со щелочными металлами реагируют как кислоты. Иными словами, щелочные металлы вытесняют водород из гидроксильной группы в молекулах спиртов:

Реакции спиртов пропанол-1 и пропанол-2 с уксусной кислотой
В реакциях с кислотами спирты проявляют основные свойства. Их взаимодействие с карбоновыми кислотами приводит к образованию сложных эфиров.

Внутримолекулярная дегидратация спиртов пропанол-1 и пропанол-2
Дегидратация спиртов проходит в присутствии серной кислоты и при нагревании. Какие при этом образуются продукты, зависит от условий. Так, внутримолекулярная дегидратация с отщеплением молекул воды и образованием двойной связи внутри молекулы идет в жестких условиях при высоких температурах

Межмолекулярная дегидратация спиртов пропанол-1 и пропанол-2
Дегидратация спиртов в более мягких условиях может приводит к образованию молекул простых эфиров:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://webhimik.ru/reshenie-zadach/sostavte-uravneniya-reakcii-spirtov-propanol-1-i-propanol-2.html http://acetyl.ru/f/r035.php |