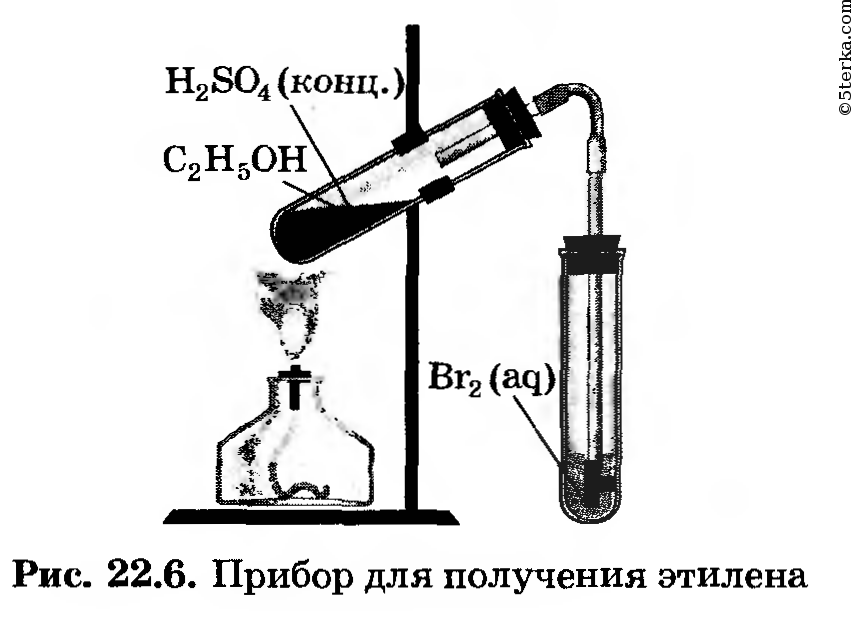
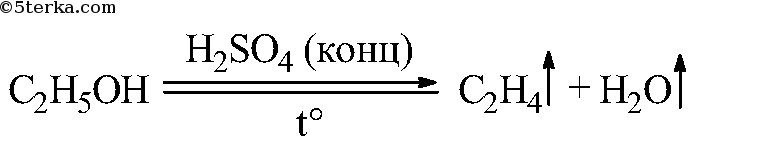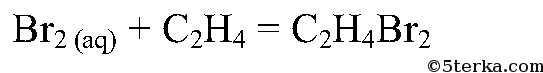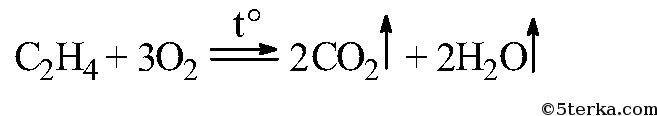Практическое занятие № 8. Получение этилена и изучение его свойств
Задания. 1. Получите этилен из этилового спирта.
2. Проведите характерные реакции для этилена как представителя непредельных углеводородов.
Оборудование. Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, чашка с песком, лабораторный штатив, горелка, спички, мензурка, свернутая спирально медная проволока, которая должна быть вложена в газоотводную трубку.
Вещества. Этиловый спирт, серная кислота (конц.), раствор бромной воды и розовый раствор подкисленного перманганата калия, промытый и прокаленный речной песок.
1. Получение этилена. Соберите прибор для получения этилена (рис. 22.6) и проверьте его на герметичность.
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка. Закройте пробирку пробкой с газоотводной трубкой и закрепите прибор в штативе.
2. В две пробирки прилейте по 2 мл растворов бромной воды и перманганата калия. Нагрейте в приборе для получения этилена смесь до кипения и, не переставая нагревать, но не перегревая, опустите конец газоотводной трубки сначала в
пробирку с бромной водой, а затем в пробирку с раствором перманганата калия.
Что вы наблюдаете? Составьте уравнения химических реакций: а) получения этилена из этилового спирта; б) взаимодействия этилена с бромной водой.
Направьте конец газоотводной трубки прибора вверх и подожгите лучиной выделяющийся этилен. Отметьте характер пламени. Внесите в пламя этилена на несколько секунд фарфоровую пластинку или чашу. Что вы наблюдаете?
Вдувайте воздух через стеклянную трубку с оттянутым концом в среднюю часть пламени этилена. Как изменяется яркость пламени? Почему? Составьте уравнение реакции горения этилена.
Концентрированная серная кислота обладает свойством отбирать воду у других веществ. Это свойство использовано для получения этилена.
Вода частично конденсируется на стенках пробирки и скатывается обратно в раствор. Этилен уходит по газообразной трубке. Свойства этилена:
При пробулькивании этилена через раствор бромной воды и перманганата происходит обесцвечивание.
Этилен горит желтым пламенем, при внесении фарфоровой чашки она чернеет, из-за неполного сгорания этилена образуется свободный углерод — сажа черного цвета. При вдувании воздуха в пламя этилена происходит полное сгорание этилена, и пламя из желтого становится синим.

задача №8
к главе «Практические занятия».
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfcdb0e982090b1 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Как из этанола получить этен
этилен > этанол
получение этанола из этилена
Чтобы получить этанол из этилена нужно к нему присоединить воду, т.е провести реакцию:
СН2=СН2 + Н2О ——> СН3-СН2-ОН. Но если просто пропускать этилен в воду, то ничего не получится. Чтобы реакция могла пройти, нужно создать условия:
1)Использовать катализатор — сильную минеральную кислоту, удобнее серную, т.е пропускать этилен через раствор серной кислоты не очень высокой концентрации(не более 20 % по массе.
2) можно использовать более слабую фосфорную кислоту, но тогда процесс придется вести в паровой фазе при высокой температуре (более 100 градусов Цельсия).
CH2=CH2 + H2O → C2H5OH.
C2H4 + H2 -> C2H6 (катализатор Ni)
CH2 =CH2+ H2O = C2H5OH
C2H4+ H2 = C2H6 (католизатор Ni)
Другие вопросы из категории
оксидов и гидроксидов-неметаллов третьего периода.
Какая масса кислорода необходимо для сгорании а) 560г железа
б) 20г водорода
Читайте также
А) из этилена;
Б)из глюкозы;
В) из крахмала;
Г)из целлюлозы.
Напишите уравнения соответствующих химических реакций.
Какой из этих способов вы выбрали бы,если бы вам предложили организовать крупно тоннажное производство этанола?
Обоснуйте ваш выбор.
кристаллизационную воду,а затем разлагается по уравнению:
2FeSO4=Fe2O3+SO2+SO3
Серный ангидрид,взаимодействуя с водой, образует серную кислоту.Этот способ получения объясняет ее старинное название-купоросное масло.Рассчитайте,какую массу 50%-го раствора серной кислоты можно получить из железного купороса массой 69,5г
названия веществам.(4) Напишите уравнение реакций, при помощи которых можно осуществить превращение: Этан этен этин щавелевая кислота кальциевая соль щавелевой кислоты(28) Сложные липиды, их классификация. Краткая характеристика различных групп сложных эфиров.(79) Что такое денатурация белков? Какие вещества вызывают денатурацию белка? Ответ обоснуйте.(88) Составьте схему получения этанола из крахмала. Запишите уравнения реакций по схеме и найдите выход этанола, если в реакцию вступала глюкоза массой 36 г и был получен этанол массой 12 г.(120) При гидролизе крахмала массой 648 г с выходом 70% получили глюкозу, которую подвергли спиртовому брожению. Выход продукта брожения составил 70%. В результате осуществления процесса образовался водный раствор спирта массой 1200 г. Определите массовую долю этанола в полученном растворе.(136)
б) какой из этих двух металлов более твердый?
в) Какой из этих двух металлов является более сильным восстановителем?
1из этана получить хлорэтан
2из этанола получить хлорэтан
3изхлорэтана получить этанол
4из этаналя получить этанол
5из этанола получить этаналь
6из этанола получить этен
7из этена получить этанол
8из этена получить этан
9из этана получить этен
10из этена получить этин
11из этина получитьэтен
12из этина получить этан
13из этана получить этин
14из этаналя получить этановую кислоту
15из этановой кислоты получить хлороэтановую кислоту
16из хлороэтановой кислоты получить аминовую кислоту
http://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/11/zadanie-1.html
http://wineandwater.ru/kak-iz-jetanola-poluchit-jeten/