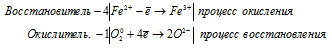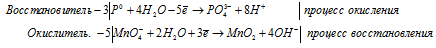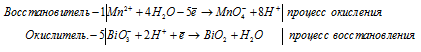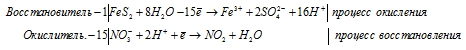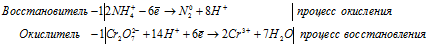Допишите и уравняйте: Fe3O4 + HNO3 → Fe(NO3)3 + NO + …
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Оксид железа (II, III)
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
http://chemege.ru/%D0%BE%D0%BA%D1%81%D0%B8%D0%B4-%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0-ii-iii/
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655