Фосфин: получение и химические свойства
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
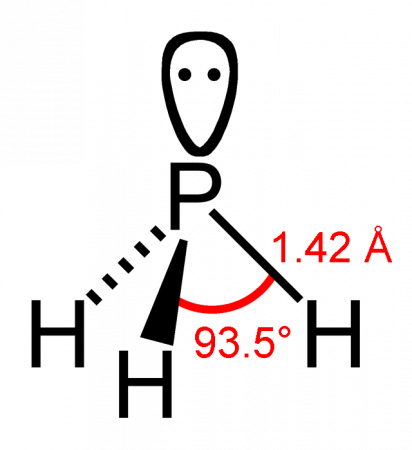
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфин
| Фосфин | |||
|---|---|---|---|
| |||
| Систематическое наименование | Фосфин | ||
| Хим. формула | PH3 | ||
| Состояние | газ | ||
| Молярная масса | 34,00 г/моль | ||
| Плотность | 1,379 г/л, газ (25 °C) | ||
| Энергия ионизации | 9,96 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −133,8 °C | ||
| • кипения | −87,8 °C | ||
| Пределы взрываемости | 1,79 ± 0,01 об.% | ||
| Энтальпия | |||
| • образования | 5,4 кДж/моль | ||
| Давление пара | 41,3 ± 0,1 атм | ||
| Растворимость | |||
| • в воде | 31,2 мг/100 мл (17 °C) | ||
| Рег. номер CAS | [7803-51-2] | ||
| PubChem | 24404 | ||
| Рег. номер EINECS | 232-260-8 | ||
| SMILES | |||
| RTECS | SY7525000 | ||
| ChEBI | 30278 | ||
| Номер ООН | 2199 | ||
| ChemSpider | 22814 | ||
| Токсичность | Чрезвычайно токсичен, СДЯВ | ||
| Пиктограммы ECB |   | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) PH3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы (чеснока).
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Самовозгорание
- 5 Токсичность
- 6 Применение
Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства. При низких температурах образует твёрдый клатрат 8 PH3·46 H2O. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому по сравнению с аммиаком, фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кислоты:
или её восстановление:
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s 2 ) ниже, чем у азота (2s 2 ) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
На воздухе горит согласно уравнению:
Проявляет сильные восстановительные свойства:
В связи с тем, что:
то возможно протекание следующей реакции:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4 + (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Самовозгорание
Абсолютно чистый и сухой фосфин не способен к самовоспламенению на воздухе и загорается только при температуре 100-150°. Однако фосфин, получающийся, например, при взаимодействии фосфидов с водой всегда имеет примесь дифосфина P2H4, который на воздухе самовоспламеняется. В частности, таким образом могут появляться «блуждающие огни».
Токсичность
Фосфин очень ядовит. Поражает в первую очередь нервную систему, нарушает обмен веществ; также действует на кровеносные сосуды, органы дыхания, печень, почки. Запах фосфина ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ может привести к летальному исходу. ПДК — 0,1 мг/м³.
При остром отравлении фосфином в лёгких случаях беспокоит боль в области диафрагмы, чувство холода, впоследствии может развиться бронхит. При среднетяжёлом отравлении — чувство страха, озноб, рвота, стеснение в груди, удушье, боль за грудиной. В тяжёлых случаях на первый план выходят неврологические симптомы — оглушение, неверная походка, подёргивания в конечностях, мидриаз; cмерть от паралича дыхания или сердечной мышцы может наступить через нескольно дней, а при высоких концентрациях — мгновенно.
Хроническое отравление может привести к расстройству зрения, походки, речи, пищеварения, бронхиту, болезням крови и жировому перерождению печени.
Применение
В 2019 году фосфин был предложен в качестве биосигнатурного газа для поиска жизни на землеподобных экзопланетах, поскольку на Земле он производится анаэробными экосистемами. Слабой стороной фосфина для этой цели является его высокая реакционная способность, что требует большой интенсивности производства этого газа для его детектирования. Для его обнаружения в атмосфере экзопланеты потребуются десятки часов наблюдения телескопа «Джеймс Уэбб».
Фосфор. Фосфин
Фосфор
Следующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».

Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 о С. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 о С) и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи. Несколько отличен от них «фиолетовый фосфор», который состоит из группировок Р8 и Р9, уложенных в длинные трубчатые структуры с пятиугольным сечением.
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.

Химические свойства
Наиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с концентрированной азотной кислотой:
— с концентрированной серной кислотой:
С другими кислотами фосфор не взаимодействует.
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Применение фосфора
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
Фосфин
Наиболее известным водородным соединением фосфора является фосфин РН3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
Соли фосфония образуются только с сильными кислотами:
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 о С самовоспламеняется на воздухе:
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
Скачать:
Скачать бесплатно реферат на тему: «Фосфор» Фосфор.doc (276 Загрузок)
а также на тему: «Фосфор и его соединения» Фосфор-и-его-соединения.doc (285 Загрузок)
Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
http://chem.ru/fosfin.html
http://al-himik.ru/fosfor-fosfin/