Напишите уравнения реакций характеризующих свойства кислот
Запишите молекулярные и ионные уравнения реакций, характеризующих свойства кислот: а) соляной; б) муравьиной; в) кремниевой; г) азотной. Там, где это имеет место, рассмотрите процесс окисления-восстановления.
Реагирует с активными металлами:
| Zn + 2HCl ⟶ ZnCl2 + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
Реагирует с оксидами металлов:
Реагирует с основаниями:
Реагируют с солями, если в результате реакции образуется осадок, или газ, или слабый электролит:
Реагирует с активными металлами:
| Zn + 2HCOOH ⟶ (HCOO)2Zn + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
Реагирует с оксидами металлов:
Реагирует с основаниями:
Реагируют с солями, если в результате реакции образуется осадок, или газ, или слабый электролит:
Реагирует со щелочами:
Реагирует с активными металлами:
| 4Zn + 10HNO3(разб.) ⟶ 4Zn(NO3)2 + N2O↑ + 2H2O | ||
| 2N +5 + 8ē ⟶ 2N + | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 4 | восстановитель (окисление) |
Реагирует с неактивными металлами:
| 3Cu + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 2NO↑ + 4H2O | ||
| N +5 + 3ē ⟶ N +2 | 2 | окислитель (восстановление) |
| Cu 0 — 2ē ⟶ Cu +2 | 3 | восстановитель (окисление) |
Реагирует с оксидами металлов:
Реагирует с основаниями:
Реагируют с солями, если в результате реакции образуется осадок, или газ, или слабый электролит:
Приведите примеры уравнений реакций, характеризующих общие свойства кислот, в молекулярном, полном ионном и сокращённом ионном видах
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Химические свойства кислот
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
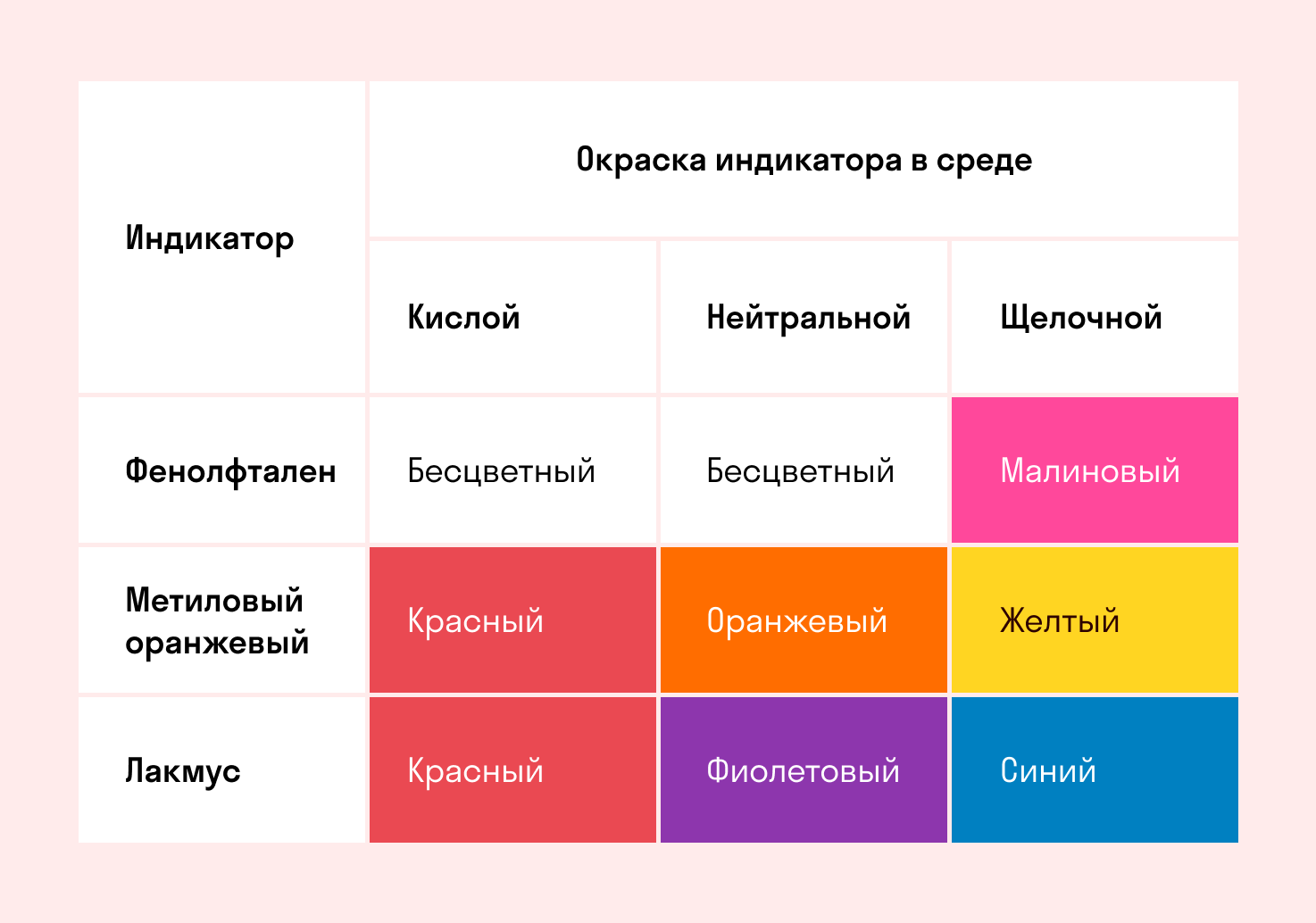
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
http://www.soloby.ru/468107/%D0%BF%D1%80%D0%B8%D0%B2%D0%B5%D0%B4%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B9-%D1%85%D0%B0%D1%80%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D0%B7%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D1%81%D0%BE%D0%BA%D1%80%D0%B0%D1%89%D1%91%D0%BD%D0%BD%D0%BE%D0%BC
http://skysmart.ru/articles/chemistry/himicheskie-svojstva-kislot