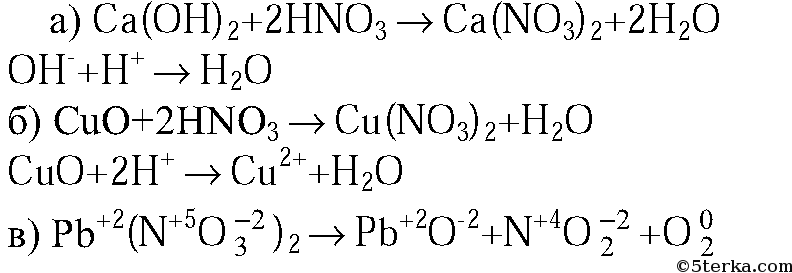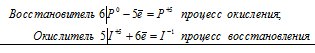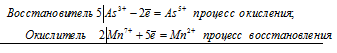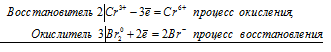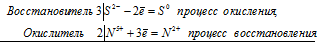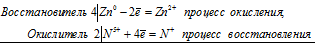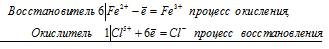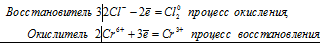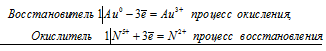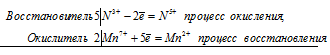Вариант 2
Вопросы:
1. Напишите молекулярные и ионные уравнения реакций между раствором азотной кислоты и: а) гидроксидом кальция; б) оксидом меди(II); в) карбонатом бария.
2. Напишите уравнение реакции разложения нитрата свинца при нагревании. Укажите степени окисления элементов и расставьте коэффициенты с помощью метода электронного баланса.
3. В трех пронумерованных пробирках находятся кристаллические вещества: нитрат натрия, сульфат натрия и нитрат аммония. Как их можно распознать? Напишите уравнения соответствующих реакций.
Ответы и решения:
3. Данные вещества можно распознать при помощи растворов нитрата бария

задача №2
к главе «Тема III. Подгруппа азота. Работа 2. Азотная кислота и ее соли».
Как правильно расставить коэффициенты в уравнении реакции окисления-восстановления
Решение задач на составление уравнений окислительно-восстановительных реакций
Задание 231.
Реакции выражаются схемами:
Р + НClО3 + Н2О ⇔ Н3РО4 + НCl;
Н3AsO3 + KMnO4 +Н2SO4 ⇔ Н3AsO4 + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а)Р + НClО 3 + Н 2О ⇔ Н 3РО 4 + НCl;
уравнения электронного баланса:
6P 0 + 5I +5 = 6P +5 + I -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов тридцать. Разделив это число на 6, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 30 на 5 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: P – восстановитель, НIО3 – окислитель; P окисляется до Н3PO4, НIО3 – восстанавливается до HI.
5As 3+ + 2Mn 7+ = 5As 5+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
5Н 3 AsO 3 +2KMnO 4 + 3Н 2 SO 4 ⇔ 5Н 3 AsO 4 + K 2 SO 4 + 2MnSO 4 + 3H 2 O
В данной реакции: Н 3 AsO 3 – восстановитель, KMnO 4 – окислитель; Н 3 AsO 3 окисляется до Н 3 AsO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 232.
Реакции выражаются схемами:
NaCrO2 + Br2 + NaOH ⇔ Na2CrO4 + NaBr + H2O
FeS + HNO3 ⇔ Fe(NO3)2 + S + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + 3Br2 0 = 2Cr 6+ + 6Br —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: NaCrO2 – восстановитель, Br2 – окислитель; NaCrO2 окисляется до Na2CrO4, Br2 – восстанавливается до NaBr.
3S 2- + 2N 5+ = 3S 0 + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeS – восстановитель, HNO3 – окислитель; FeS окисляется до S, HNO3 – восстанавливается до NO.
Задание 233.
Реакции выражаются схемами:
HNO3 + Zn ⇔ N2O + Zn(NO3)2 + H2O;
FeSO4 + KClO3 + H2SO4 ⇔ Fe2(SO4)3 + KCl + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Zn 0 + 2N 5+ = 4Zn 2+ + 2N +
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 4, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Zn – восстановитель, HNO3 – окислитель; Zn окисляется до Zn(NO3)2, HNO3 – восстанавливается до N2O.
6Fe 2+ + Cl 5+ = 6Fe 3+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 1 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeSO4 – восстановитель, KClO3 – окислитель; FeSO4 окисляется до Fe2(SO4)3, KClO3 – восстанавливается до KCl.
Задание 234.
Реакции выражаются схемами:
K2Cr2O7 + HCl ⇔ Cl2 + CrCl3 + KCl + H2O;
Au + HNO3 + HCl ⇔ AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, K2Cr2O7 – окислитель; HCl окисляется до Сl2, K2Cr2O7 – восстанавливается до CrCl3.
Au 0 + N 5+ = Au 3+ + N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Здесь число отданных электронов и число принятых электронов равно 3, поэтому коэффициенты при восстановителе и окислителе, и перед продуктами окисления и восстановления равны 1. Молекулярное уравнение реакции:
В данной реакции: Au – восстановитель, HNO3 – окислитель; Au окисляется до AuCl3, HNO3 – восстанавливается до NO.
Задание 235.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и КМnO4 б) HNO2 и HI; в) НСI и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Решение:
а) Степень окисления в NH3 n(N) = -3 (низшая); в KMnO4 n(Mn) = +7 (высшая). Так как азот находится в своей низшей степени окисления, а марганец – в своей высшей степени окисления, то взятые вещества могут взаимодействовать друг с другом, причём NH3 является окислителем, а KMnO4 – восстановителем.
б) в HNO2 n(N) = +3 (промежуточная); в HI n(I) = -1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем HI является окислителем, а HNO2 – восстановителем.
в) в HCl n(Cl) = -1 (низшая); в H2S n(S) = -2 (низшая). Так как и хлор, и сера находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
г) КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Mn 7+ + 5N 3+ = 2Mn 2+ + 5N 5+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Расстановка коэффициентов в уравнении онлайн
Рекомендации по пользованию сервисом
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять»
2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
3) Изредка возникают ситуации, когда формулы реагентов и продуктов записаны абсолютно верно, но коэффициенты все равно не расставляются. Такое может возникать в тех случаях, если коэффициенты в уравнении могут быть расставлены двумя или более способами. Наиболее вероятно возникновение такой проблемы с реакциями окисления органических веществ при которых рвется углеродный скелет. В таком случае попробуйте заменить неизменяемые фрагменты органических молекул на какой-нибудь произвольный символ, например радикал фенил C6H5 можно обозначить как Ph или X. Например, следующее уравнение:
не будет сбалансировано, так как возможна разная расстановка коэффициентов. Однако, введя обозначение C6H5 = Ph, расстановка коэффициентов происходит корректно:
Примечание
В уравнении допускается для разделения формул реагентов от формул продуктов использовать как знак равенства (=), так и стрелку (→), а также случайная запись отдельных букв символов химических элементов не латиницей, а кириллицей в случае их идентичного написания, как, например, символов C, H, O, P.
В случае, если программа оказалась полезной для Вас вы можете поделиться ссылкой на нее с друзьями в социальных сетях (кнопка внизу).
http://buzani.ru/zadachi/khimiya-shimanovich/936-okislitelno-vosstanovitelnye-reaktsii-zadaniya-231-235
http://scienceforyou.ru/rasstanovka-kojefficientov-onlajn