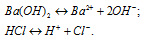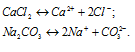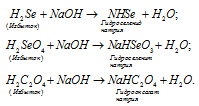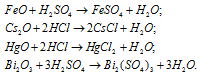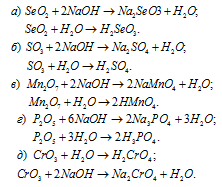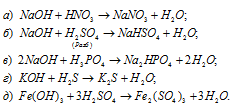Решение задач по теме «Классы неорганических соединений»
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba 2+ и Cl – не связываются с ионами H + и OH – с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca 2+ и CO3 – связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl – и OH – , которые не связываются друг с другом, молекулами CaCO3 и ионами воды H + и OH — . Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ag + и Cl — связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na + и NO3 — , которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K + + Cl — ;
NaNO3 ⇔ Na + + NO 3 — .
Образовавшиеся ионы K + , Na + , Cl — и NO 3 — не связываются друг с другом и ионами воды H + и OH — и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
В присутствии избытка кислорода в воде образуется только азотная кислота:
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0 С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag + и NO3 — , а соляная кислота как электролит распадается на ионы H + и Cl — . Ионы Ag + и Cl — , соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Ионы PO4 3- , SO4 2- , H + и Cl — не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu 2+ + SO4 2- ;
NaOH ⇔ Na + + OH —
Ионы Cu 2+ и OH — связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6] 4- :
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
б) Действием кислоты на основание:
в) Действием кислоты на соль:
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена). При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
Примеры решения задач. Пример 1.1.Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Пример 1.1.Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Решение. NaOH (гидроксид натрия) – основание (щелочь). Щелочи можно получить взаимодействием активного металла (в данном примере натрия) с водой:
NaHS (гидросульфид натрия) – кислая соль. Кислые соли получаются при действии на многоосновные кислоты недостатком основания (щелочи):
Na2S (сульфид натрия) – средняя соль. Образуется при действии избытка щелочи на кислую соль:
Na2SO4 (сульфат натрия), NaCl (хлорид натрия) – средние соли. Средние соли можно получить взаимодействием кислоты и соли:
взаимодействием двух солей:
Пример 1.2. С какими из указанных ниже веществ будет взаимодействовать H2SO4: CO2; NaOH; BaCl2; HCl; Fe2O3. Написать уравнения соответствующих реакций.
Решение. Определяем, к каким классам относятся указанные соединения: CO2 – кислотный оксид, NaOH – основание (щелочь), BaCl2 – соль, HCl − кислота, Fe2O3 – основной оксид. Серная кислота будет взаимодействовать с основанием, основным оксидом и солью:
Задачи
№ 1.1. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:

б) Какие из приведенных веществ будут взаимодействовать между собой: Ca(OH)2 и NaOH; Pb(OH)2 и KOH; H2SO4 и H2SO3; HCl и Na2S; HNO3 и MgO? Написать уравнения соответствующих реакций.
№ 1.2. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Какие из приведенных оксидов будут реагировать с HCl: N2O5; SO3; Al2O3; Cl2O7; ZnO; K2O? Написать уравнения соответствующих реакций.
№ 1.3. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Закончить уравнения реакций, доказывающих амфотерность оксида свинца (II):
основные свойства PbO + HNO3 →
кислотные свойства PbO + KOH
№ 1.4. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Какие из приведенных оксидов реагируют с NaOH: MgO; Cr2O3; Na2O; CrO3; CaO; CO2? Составить уравнения соответствующих реакций.
№ 1.5. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) С какими из указанных ниже веществ может взаимодействовать раствор KOH: HI; CuCl2; SO2; Ba(OH)2; PbO? Написать уравнения соответствующих реакций.
№ 1.6. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: Na 2S; Fe2(SO4)3; K 3PO4.
№ 1.7.а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3; CaHРO4; CuOHCl.
№ 1.8. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Между какими из приведенных пар веществ возможна реакция:
CO2 и SO2; LiOH и CO2; P2O5 и CaO; NaOH и KOH; Li2O и ZnO; Li2O и Na2O? Составить уравнения соответствующих реакций.
№ 1.9. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) С какими из указанных ниже веществ может взаимодействовать серная кислота: HCl; BaCl2; MgO; CO2; NaOH; ZnO? Составить уравнения соответствующих реакций.
№ 1.10. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Написать уравнения реакций образования солей: Na2SO3; Fe2(SO4)3; Ba(NO3)2 в результате взаимодействия основания и кислотного оксида.
№ 1.11. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Составить уравнения реакций образования солей: CaCO3; Al2(SO4)3; Na3PO4 в результате взаимодействия основного и кислотного оксидов.
№ 1.12. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Закончить уравнения реакций, доказывающих амфотерность оксида олова (II):
основные свойства SnO + HCl →
кислотные свойства SnO + KOH
№ 1.13. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Какие из приведенных оксидов взаимодействуют с КОН: Na2O; CO2; Al2O3; MgO; Fe2O3; Mn2O7? Написать уравнения соответствующих реакций.
№ 1.14. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Как, используя простые вещества – кальций, фосфор и кислород, можно получить фосфат кальция? Написать уравнения соответствующих реакций.
№ 1.15. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Составить уравнения реакций, при помощи которых, исходя из четырех простых веществ – калия, серы, водорода и кислорода, можно получить КОН; K2S; H2S.
№ 1.16. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Написать уравнения не менее четырех реакций, при помощи которых можно получить карбонат кальция.
№ 1.17. а) Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Написать уравнения реакций образования K2CrO4, Mg(NO3)2, BaSO4, Ca(ClO)2 в результате взаимодействия основания и кислотного оксида.
№ 1.18. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Могут ли находиться совместно в растворе: Ba(OH)2 и FeCl3; HCl и H2S; NaOH и НBr; NaOH и KOH; HCl и Na2CO3? Дать обоснованный ответ и привести уравнения соответствующих реакций.
№ 1.19. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Как, используя BaO, FeCl3, H2SO4, H2O, CuO, можно получить: гидроксид бария; гидроксид железа; сульфат меди? Составить уравнения соответствующих реакций.
№ 1.20. а) Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
б) Составить уравнения четырех реакций, в результате которых образуется бромид натрия.
Напишите уравнения реакций между двумя основаниями
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
http://helpiks.org/5-20579.html
http://kardaeva.ru/89-dlya-uchenika/9-klass/140-reaktsii-ionnogo-obmena-i-usloviya-ikh-protekaniya