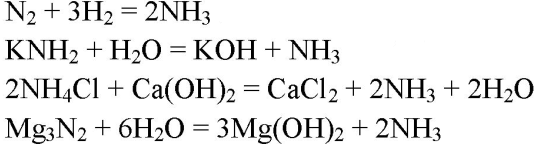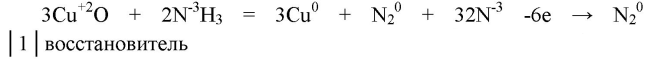Характеристика свойств соединений азота
Задача 887.
Какой объем аммиака (условия нормальные) можно получить, подействовав двумя литрами 0,5 н. раствора щелочи на соль аммония?
Решение:
При действии на соли аммония щёлочью получается эквивалентное количество аммиака:
Находим количество щёлочи, пошедшее на реакцию с солью аммония, получим:
1 : 0,5 = 2 : х; х = (0,5 . 2)/1= 1 моль.
1 моль любого газа при нормальных условиях занимает объём равный 22,4 л.
Отсюда находим, что объём аммиака, выделившегося при реакции, равен:
V(NH3) = VЭ . (NH3) = 22,4 . 1 = 22,4 л.
Ответ: 22,4 л.
Задача 888.
Можно ли в качестве осушителей газообразного аммиака применять Н2SO4 или Р2О5? Ответ мотивировать.
Решение:
Н2SO4 и Р2О5 очень энергично взаимодействуют с водой, серная кислота с образованием кристаллогидратов, а оксид фосфора (V) – с образованием ортофосфорной кислоты Н3РО4:
Поэтому они являются осушителями газовых смесей. В обоих случаях образуются кислоты, с которыми взаимодействует аммиак, образуя соответствующие соли:
Таким образом, Н2SO4 и Р2О5 нельзя применять в качестве осушителя аммиака, так как при этом происходит химическое взаимодействие аммиака с серной и фосфорной кислотами.
а) (NH4)2CO3 
б) NH4NO3 
2NH4NO3 
в) (NH4)2SO4 
г) NH4С1 
д) (NH4)2HPO4 
е) (NH4)H2PO4 
ж) (NH4)2Cr2O7 
з) NH4NO2 
Задача 890.
Нитрат аммония может разлагаться двумя путями:
NH4NO3(к) 
NH4NO3(к) 
Какая из приведенных реакций наиболее вероятна и какая более экзотермичная при 25 °С? Ответ подтвердить расчетом ΔG 0 298 и ΔH 0 298. Как изменится вероятность протекания этих реакций при повышении температур?
Решение:
а) Уравнение реакции имеет вид:
NH4NO3(к) 
Находим ΔH 1 0 реакции, учитывая закон Гесса, получим:
ΔH 1 0 = 2 ΔH 0 (Н2О) + ΔH 0 (N2O) — ΔH 0 (NH4NO3) =
= 2(-241,8) + 82,0 – (-365,4) = -36,2кДж.
ΔG1 0 = 2 ΔG 0 (Н2О) + ΔG 0 (N2O) — ΔG 0 (NH4NO3) =
= 2(-228,6) + 104,1 – (-183,8) = -169,3 кДж.
б) Уравнение реакции имеет вид:
NH4NO3(к) 
Находим реакции, учитывая закон Гесса, получим:
Находим энергию Гиббса реакции, получим:
ΔH2 0 ΔH 1 0 и ΔG2 0 ΔG 1 0 , поэтому вторая реакция, реакция (б) наиболее вероятна при 25 0 С и более зкзотермична, чем реакция (а). Так как обе реакции экзотермичны, то, согласно принципу Ле Шателье, при повышении температуры равновесие обеих реакций сместится влево. Вероятность протекания реакции(б), как наиболее экзотермичной, значительно уменьшится при повышении температуры, чем реакции (а).
Вопросы к параграфу 24 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 24. Аммиак
Вопросы и задания
1. Напишите уравнения четырёх химических реакций, в результате которых образуется аммиак.
2. При пропускании аммиака через трубку с накалённым оксидом меди(II) образуется медь. Напишите уравнение этой реакции, укажите окислитель и восстановитель. Покажите переход электронов.
3. Поясните, какие химические свойства аммиака используют при получении продуктов, указанных на рисунке 21.
Сырьё для производства азотных удобрений (реакции с кислотами с образованием аммиачных солей).
Аммиак входит в состав средств бытовой химии.
Сырьё для производства азотной кислоты (каталитическое окисление).
Производство взрывчатых веществ (реагирует с кислотами с образованием аммиачной соли).
Поурочные задания по теме Азот и его соединения
Задания составлены по темам: «Общая характеристика подгруппы азота. Азот», » Аммиак. Соли аммония», Оксиды азота», «Азотная кислота и ее соли». Могут быть использованы на уроках, в качестве индивидуальных домашних заданий для проверки усвоения материала
Просмотр содержимого документа
«Поурочные задания по теме Азот и его соединения»
Общая характеристика элементов подгруппы азота. Азот
1. Составьте электронные схемы атомов азота и фосфора, отметьте сходства и различия между ними.
2. Укажите, что является мельчайшей частицей азота:
а) как элемента б) как простого вещества
3. Напишите электронную схему атома азота и электронную формулу молекулы азота. Укажите валентность и степень окисления атомов в молекуле азота.
4. Наиболее выраженными кислотными свойствами обладает оксид, формула которого: а) Sb2O5 б) P2O5 в) As2O5 г) N2O5. Напишите формулу кислоты, которая соответствует этому оксиду.
5. Процессу окисления соответствует схема превращений:
6. Азот образуется при разложении вещества, формула которого:
а) NH4NO3 б) NH4NO2 в) HNO3 г) NaNO3 Напишите уравнение соответствующей реакции, коэффициенты расставьте методом электронного баланса, укажите окислитель и восстановитель.
7. Формула оксида, который образуется в земной атмосфере при электрических разрядах
а) N2O б) SO2 в) NO2 г) NO Напишите уравнение реакции образования этого оксида, составьте схему электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
8. С азотом при комнатной температуре реагирует:
а) кальций б) водород в) кислород г) литий Напишите уравнение соответствующей реакции, коэффициенты расставьте методом электронного баланса, укажите окислитель и восстановитель.
9. Вычислите объемы азота и водорода, необходимых для получения 33,6 л аммиака (н.у.).
10. По термохимическому уравнению обратимой реакции
N2(г.) + O2(г.) ↔ 2NO(г.) – 180,8 кДж вычислите количество теплоты, которая потребуется для синтеза 67,2 л (н.у.) оксида азота(II).
1. Атом азота имеет валентность IV и степень окисления -3 в соединении состава:
2. Степень окисления атома азота увеличиваются в ряду:
3. Сокращенное ионно-молекулярное уравнение NH4 + + OH — = NH3 + H2O
описывает взаимодействие веществ, формулы которых:
4. Аммиак реагирует с каждым веществом ряда:
Напишите уравнения реакций веществ этого ряда с аммиаком
5. Составьте уравнения следующих превращений: NO → N2 → NH3 → NH4HSO4
Для уравнения реакции 1 составьте схему электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления. Для реакции 3 напишите ионно-молекулярное уравнение.
6. Даны вещества: аммиак, кислород, вода. Составьте уравнения реакций, в результате которых из данных веществ можно получить 4 новых вещества. Укажите условия их протекания.
7. Высказывание «нет дыма без огня» несправедливо для химического взаимодействия двух веществ, формулы которых:
8. Пропусканием через серную кислоту нельзя осушить: а) аммиак б) кислород в) хлор г) углекислый газ
9. Нашатырный спирт – это водный раствор аммиака. В аптеке для получения нашатырного спирта в 300 г воды растворили 112 л аммиака (н.у.). Вычислите массовую долю (%) аммиака в полученном растворе.
10. В процессе синтеза аммиака начальная концентрация водорода составляла 0,49 моль/л, а через 5 с – 0,09 моль/л. Вычислите среднюю скорость реакции.
1. Формулы несолеобразующих оксидов записаны в ряду:
2. Оксид азота(IV) реагирует с каждым веществом ряда:
Напишите уравнения реакций веществ этого ряда с оксидом азота(IV), коэффициенты расставьте методом электронного баланса, укажите окислители и восстановители.
3. Составьте уравнения следующих превращений: N2 → NO → NO2 → HNO3 → Al(NO3)3
Для уравнения 3 составьте схему электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления. Для реакции 4 напишите молекулярное и ионно-молекулярное уравнение.
4. В одном закрытом цилиндре находится оксид азота(II), в другом – оксид азота(IV), а в третьем – азот. Укажите, как можно различить эти газы?
5. Влажная лакмусовая бумажка краснеет при внесении ее в сосуд с газом, формула которого:
6. Коэффициент перед формулой восстановителя в уравнении реакции
а) 5 б) 4 в) 3 г) 2
7. Коэффициент перед формулой окислителя в уравнении реакции
а) 5 б) 8 в) 10 г) 4
8. Оксид азота(IV) объемом 2,24 л (н.у.) растворили в 94,6 г воды в присутствии кислорода. Определите массовую долю кислоты (%) в полученном растворе.
9. Определите, во сколько раз увеличится скорость реакции между кислородом и оксидом азота(II) при повышении температуры от 10 до 130 0 С, если при повышении температуры на каждые 10 0 С скорость реакции увеличивается в 2 раза.
Азотная кислота и ее соли. Круговорот азота в природе.
1. Формула соединения, в котором атом азота проявляет высшую степень окисления:
Составьте электронную схему атома азота в этой степени окисления
2. Разбавленная азотная кислота реагирует с каждым веществом ряда:
Напишите уравнения реакций веществ этого ряда с разбавленной азотной кислотой. Для ОВР составьте схему электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления
3. Азотную кислоту можно отличить от серной кислоты, используя:
а) разбавление б) охлаждение в) нагревание г) карбонат натрия
4. Характерными свойствами азотной кислоты являются:
1) разложение на свету 2) воспламенение тлеющей лучинки над кипящей кислотой 3) окрашивание белков в желтый цвет 4) выделение оксида азота(V) в реакции с магнием 5) свечение в темноте 6) выделение оксида азота(IV) в реакции с медью.
В этом перечне число неправильно указанных свойств равно:
а) 5 б) 4 в) 3 г) 2.
5. Допишите уравнения реакций и расставьте коэффициенты:
6. При обработке технической меди, содержащей 4% примесей, разбавленной азотной кислотой выделилось 28 л (н.у.) газа. Определите массу технической меди.
http://gdzwow.com/answers/9-himiya-uch-rudzitis-vopr-k-par-24.html
http://multiurok.ru/files/pourochnyie-zadaniia-po-tiemie-azot.html