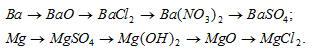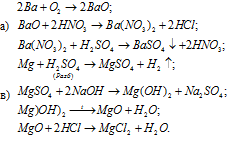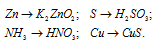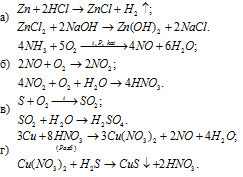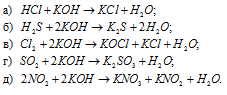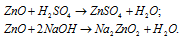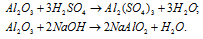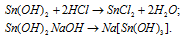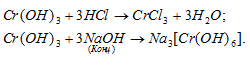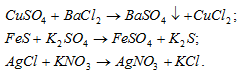2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Как решать задачи с участием кислот и оснований
Задача 140.
Написать формулы ангидридов указанных кислот: H2SO4; H3BO3; Н4P2O7; НОСI; HMnO4.
Решение:
Ангидридами кислот называют оксиды, которые при взаимодействии с водой образуют кислоту.
H2SO4 – серная кислота, которой соответствует ангидрид SO3;
H3BO3 – ортоборная кислота, которой соответствует ангидрид B2O3;
H4P2O7 – тетраметафосфорная кислота, которой соответствует ангидрид P2O5;
HOCl – хлорноватистая кислота, которой отвечает ангидрид Cl2O;
HMnO4 – марганцевая кислота, которой отвечает ангидрид Mn2O7.
Задача 141.
Написать формулы оксидов, соответствующих указанным гидроксидам: H2SiО3; Сu(ОН)2; Н3АsО4; Н2WO4; Fе(ОН)3.
Решение:
H2SiО3 – кремниевая кислота, которой соответствует оксид SiO2;
Сu(ОН)2 – гидроксид меди (II), которому соответствует оксид CuO;
Н3АsО4 — мышьяковая кислота, которой соответствует оксид As2O5;
Н2WO4 – вольфрамовая кислота, которой соответствует оксид WO3;
Fе(ОН)3 – гидроксид железа (III), которому соответствует оксид Fe2O3.
Задача 142.
Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
Решение:
Задача 143.
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение:
Задача 144.
Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСI, Н2S, NO2, N2, С12, СН4, SO2, NH3? Написать уравнения соответствующих реакций.
Решение:
С раствором щёлочи в обычных условиях реагируют следующие газы: НСI, Н2S, NO2, С12, SO2. Азот (N2), метан (СН4) и аммиак (NH3) в обычных условиях не взаимодействуют с раствором buzani.ru/raznoe/stati/1594-klassifikatsiya-neorganicheskikh-veshchestv.
Уравнения реакций:
Задача 145.
Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, К3PO4, ВаСI2? Написать уравнения реакций и назвать полученные соли.
Решение:
Имея в своём распоряжении CuSO4, AgNO3, К3PO4, ВаСI2 можно получить следующие соли:
а) При взаимодействии CuSO и К3PO4 образуется нерастворимая соль ортофосфат меди:
б) Реакция CuSO4 с ВаСI2 протекает с выпадением в осадок нерастворимого сульфата меди:
в) при взаимодействии AgNO3 и К3PO4 образуется нерастворимая соль фосфата серебра:
г) При сливании растворов AgNO3 и ВаСI2 выпадает осадок нерастворимого хлорида серебра:
д) При сливании растворов К3PO4 и ВаСI2 выпадает осадок нерастворимого ортофосфата бария:
Таким образом, можно получить следующие нерастворимые соли: Cu3(PO4)2 – ортофосфат меди (II); BaSO4 – сульфат бария; Ag3PO4 – ортофосфат серебра; AgCl – хлорид серебра; Ba3(PO4)2 – ортофосфат бария.
Задача 146.
Назвать следующие соединения: К2О2, МnO2, ВаО2, МnО, СrO3, V2O5.
Решение:
а) К2О2 – пероксид калия;
б) МnO2 — оксид марганца (IV);
в) ВаО2 – пероксид бария;
г) МnО – оксид марганца (II);
д) СrO3 – оксид хрома (VI);
е) V2O5 – оксид ванадия (V).
Задача 147.
Как доказать амфотерный характер ZnO, А12O3, Sn(ОН)2, Cr(ОН)3?
Решение:
а) ZnO – оксид цинка – амфотерный оксид, который реагирует с кислотами, образуя соль и воду, с основаниями – цинкаты.
б) А12O3 – оксид алюминия – амфотерный оксид, который реагирует с кислотами с образованием соли и воды, с основаниями – алюминаты.
в) Sn(ОН)2 – гидроксид олова (II) – амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с основаниями – тригидроксостаннаты (II).
г) Cr(ОН)3 – гидроксид хрома (III) амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с концентрированным раствором NaOH – гексагидроксохроматы (III).
Задача 148.
Можно ли осуществить в растворах указанные ниже реакции:
Решение:
а) Хлорид бария и другие его растворимые соли являются качественными реактивами на обнаружение ионов SO4 2– В результате реакции выпадает осадок нерастворимого сульфата бария:
б) Сульфид железа нерастворимая соль, поэтому при приливании к нему раствора сульфата калия реакция не идёт. Потому что в растворе находятся только ионы K + и SO4 2- , которые образуются при диссоциации сульфата калия, как сильного электролита:
Ионы K + и SO4 2- не связываются с ионами воды H + , OH — и молекулами FeS – реакция не идёт.
в) AgCl – нерастворимая соль, поэтому при приливании к ней раствора KNO3 реакция не идёт. Потому что в растворе находятся только ионы K + и NO3 — , которые образуются при диссоциации сильного электролита нитрата калия:
Ионы K + и NO3 — не связываются с ионами воды H + , OH — и молекулами AgCl – реакция не идёт.
Урок №48. Химические свойства кислот
Химические свойства кислот
Универсальная индикаторная бумага
» jsaction=»rcuQ6b:WYd;»>
2.Реагируют с металлами в ряду активности до H 2 (искл. HNO 3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H 2 ↑ (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O ( р. обмена)
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO 4 > HBr > HCl > H 2 SO 4 > HNO 3 > HMnO 4 > H 2 SO 3 > H 3 PO 4 > HF > HNO 2 >H 2 CO 3 > H 2 S > H 2 SiO 3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
№3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
http://buzani.ru/zadachi/khimiya-glinka/1091-osnovaniya-i-kisloty-zadachi-140-148
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-48-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82