Из бензола получить пирокатехин и гидрохинон?
Химия | 10 — 11 классы
Из бензола получить пирокатехин и гидрохинон.
Моноклинные кристаллы (растворитель перекристаллизации — бензол)
Молекулярная масса (в а.
Температура плавления (в °C) : 105
Температура кипения (в °C) : 245, 9
Растворимость (в г / 100 г или характеристика) :
ацетон : хорошо растворим
диэтиловый эфир : растворим
этанол : хорошо растворим
Метод получения 1.
(лабораторный синтез) К раствору 122 г (1 мол.
) чистого салицилового альдегида (примечание 1) в 1000 мл 1 н.
Раствора едкого натра добавляют при комнатной температуре 1420 г (1, 2 мол.
) 3% — ной перекиси водорода.
Смесь слегка темнеет, и температура повышается до 45— 50°.
Раствор оставляют стоять 15—20 час, после чего прибавляют несколько капель уксусной кислоты для нейтрализации избытка щелочи ; затем раствор упаривают в вакууме досуха на водяной бане.
Оставшийся сухой осадок хорошо измельчают и нагревают почти до кипения с 500 мл толуола ; затем смесь выливают на складчатый фильтр экстракционного аппарата и экстрагируют кипящим толуолом в течение 5 часов.
Толуольный раствор охлаждают и сливают с выпавшего пирокатехина.
Нерастворимый осадок вновь растирают и экстрагируют в том же аппарате ранее слитым толуолом.
В результате двух экстракций получают 70—76 г светло — коричневых пластинок с т.
Этот продукт достаточно чист для большинства целей.
После отгонки толуола из маточного раствора получают еще 6—12 г пирокатехина.
Для получения совершенно чистого продукта неочищенный пирокатехин перегоняют в вакууме, причем он нацело переходит при 119—121 С / 10 мм (или 113—115° / 8 мм) ; перегнанный продукт перекристаллизовывают из 5 — кратного количества (по весу) толуола.
Таким путем получают бесцветные пластинки с т.
Выход очищенного продукта : 76—80 г (69—73% теоретич.
В случае применения технического салицилового альдегида (не очищенного через бисульфитное соединение) получают значительно меньший выход (50% или еще меньше) .
2. Вышеописанный метод применим почти ко всем оксиальдегидам, в которых гидроксильные и карбонильные группы находятся по отношению друг к другу в орто — или пара — положении ; в последнем случае получают производные гидрохинона.
Если гидроксильные и карбонильные группы занимают мета — положение, то реакция не идет, так же как и в случае некоторых орто — и пара — соединений, содержащих нитрогруппы или атомы иода.
О — Оксиацетофенон и п — оксиацетофенон также образуют в указанных выше условиях соответственно пирокатехин и гидрохинон.
3. Пирокатехин может быть получен также окислением салицилового альдегида с помощью некоторых производных перекиси водорода, например, персульфатов и перекиси натрия.
Однако этот метод значительно менее удобен.
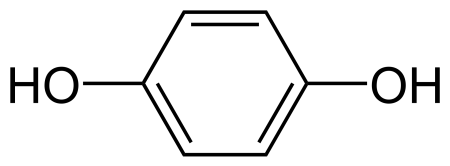
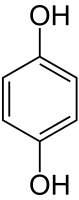
Гидрохинон
| Гидрохинон | |
|---|---|
 | |
  | |
| Систематическое наименование | бензол-1,4-диол |
| Хим. формула | C6H6O2 |
| Молярная масса | 110,11 г/моль |
| Плотность | 1.36 г/см³ |
| Энергия ионизации | 7,95 ± 0,01 эВ |
| Т. плав. | 173,8—174,8 °C |
| Т. кип. | 286,5 °C |
| Т. всп. | 165 °C |
| Давление пара | 1,0E-5 ± 0,00001 мм рт.ст. |
| Растворимость в воде | 5,26 г/100 мл (5 °С) 21,21 г/100 мл (50 °С) 56,25 г/100 мл (70 °С) |
| Растворимость в спирте | 127,27 г/100 г |
| Растворимость в ацетоне | 77,94 г/100 г |
| ГОСТ | ГОСТ 2549-60 ГОСТ 19627-74 |
| Рег. номер CAS | 123-31-9 |
| PubChem | 785 |
| Рег. номер EINECS | 204-617-8 |
| SMILES | |
| RTECS | MX3500000 |
| ChEBI | 17594 |
| ChemSpider | 764 |
| ЛД50 | 302 мг/кг (крысы, перорально) |
| Пиктограммы СГС |     |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрохинон (пара-дигидроксибензол, бензол-1,4-диол, хинол) — ароматическое органическое соединение, представитель двуатомных фенолов с химической формулой C6H4(OH)2, изомер пирокатехина и резорцина. Название «гидрохинон» дано соединению Ф. Вёлером из-за схожести свойств с хиноном, из которого Вёлер его синтезировал. Сильный восстановитель, используется как проявитель в фотографии, антиоксидант в химической промышленности, реагент для определения ниобия, вольфрама, золота и цезия в аналитической химии.
Торговое наименование: H-142.
Содержание
- 1 История
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Аналитическое определение
- 3.2 Фотографическое проявление
- 4 Получение
- 5 Применение
- 5.1 Применение в аналитической химии
- 5.2 Применение в фотографии
- 6 Правовой статус
- 7 Биологическая роль
- 8 Безопасность
История
Впервые был выделен французскими химиками Пьером Жозефом Пеллетье и Жозефом Бьенеме Каванту при перегонке хинной кислоты в 1820 году. Синтез гидрохинона первым осуществил Фридрих Вёлер в 1844 году восстановлением хинона. Также Вёлер дал ему современное название и описал его свойства.
Уильям Эбней в 1880 году обнаружил проявляющие свойства соединения, что привело к разработке способов промышленного синтеза. Дальнейшие опыты с гидрохиноном привели к созданию проявителей с двумя проявляющими веществами. Первый из таких проявителей получил Генри Дж. Ньютон в 1889 году, добавив гидрохинон к эйконогеновому проявителю, и получив итоговый состав, который использовал лучшие свойства обоих проявляющих веществ. Вскоре после этого были предложены метол-гидрохиноновые проявители (обозначающиеся символами MQ в англоязычных источниках), в которых был замечен феномен супераддитивности — эффект, когда проявитель с двумя разными проявляющими веществами работает значительно более активно, чем это должно было быть, если исходить из расчета суммы активности обоих проявляющих веществ. Эффект супераддитивности был подтвержден и обоснован научными работами Левенсона в конце 1940-х годов, который показал, что в таком случае проявление изображения ведется метолом, а роль гидрохинона заключается в регенерации отработанного метола.
Открытие Дж. Д. Кендаллом проявляющей способности фенидона в 1940 году привело к созданию еще более эффективной системы фенидон-гидрохиноновых проявителей (PQ в англоязычной литературе). Фенидон мало пригоден для использования в качестве единственного проявляющего вещества, так как дает сильное вуалирование фотоматериала, но в супераддитивных проявителях с гидрохиноном эта особенность исчезает, давая качественное итоговое изображение, значительное ускорение процесса обработки, меньшую токсичность и другие преимущества по сравнению с метол-гидрохиноновыми составами.
Физические свойства
Белые или бесцветные призматические кристаллы, сладковатые на вкус. Имеет модификации, отличающиеся физическими свойствами: стабильная α-модификация имеет температуру плавления 173,8—174,8 °C и плотность 1,36 г/см 2 , нестабильная γ-модификация — температуру плавления 169 °C и плотность 1,325 г/см 2 . Имеет молярную массу 110,11 г/моль, температуру кипения 286,5 °C, температуру вспышки 165 °C. Возгоняется при 163,5 °C (10 мм рт. ст.).
Растворим в воде (5,26 г/100 мл при 5 °С, 21,21 г/100 мл при 50 °С, 56,25 г/100 мл при 70 °С), спирте (127,27 г/100 г), ацетоне (77,94 г/100 г). Образует клатраты. В частности, клатрат с метанолом имеет формулу 3C6H6O2·CH3OH.
Реактив может содержать примеси, выглядящие как нерастворимый чёрный порошок. Количество примесей возрастает при длительном или неправильном хранении и при их большом количестве реактив становится непригодным к использованию.
Химические свойства
Является сильным восстановителем. Процесс взаимодействия с окислителями происходит в два этапа — на первом гидрохинон превращается в хингидрон, на втором — в 4-бензохинон.
При взаимодействии с водным раствором карбоната калия при 130 °С превращается в 2,5-дигидроксибензойную кислоту, с метиламином под давлением при 200 °С образует 4-метиламинофенол, с малеиновым ангидридом — нафтазарин, с фталевым ангидридом дает хинизарин. Образует простые моно- и диэфиры при обработке алкилирующими реагентами.
Аналитическое определение
Гидрохинон может быть определён при помощи цветных реакций:
- появление окраски от жёлто-зеленой до золотистой при нагревании гидрохинона до 100 °С с нитритом натрия и разбавленой серной кислотой. При добавлении гидроксида натрия окраска изменяется до жёлто-коричневой;
- появление темно-красной окраски при добавлении азотной кислоты, постепенно переходящей в жёлтый цвет.
Фотографическое проявление
Обладает проявляющими свойствами, восстанавливая бромистое серебро в щелочных растворах с образованием 4-бензохинона и бромоводорода с общим уравнением:
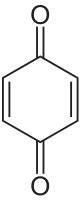
Проявление начинается при pH выше 9,. Процесс состоит из нескольких стадий:
- в щелочной среде гидрохинон диссоциирует в дианион гидрохинона:

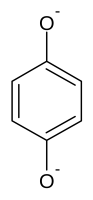
- дианион гидрохинона окисляется на центре проявления с образованием на первой стадии иона семихинона и 4-бензохинона на второй:
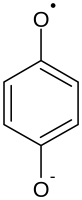

- ионы серебра восстанавливаются до металлического серебра:
2Ag + + 2e — ⟶ 2Ag
Получение
Изначально гидрохинон был получен из хинона. Разные варианты данного способа по-прежнему применяют для лабораторного получения реактива; для этого, например, проводят восстановление водного раствора 4-бензохинона, используя диоксид серы.
В промышленности синтезируют следующими способами:
- окислением 1,4-диизопропилбензола воздухом, затем проводят кислотный гидролиз полученного бис-гидропероксида с образованием гидрохинона и ацетона;
- гидроксилированием фенола 70 % перекисью водорода при 90 °С с использованием в качестве катализаторов 75 % ортофосфорную кислоту или 65 % хлорную кислоту. В результате реакции образуется смесь гидрохинона и пирокатехина, которую в дальнейшем разделяют ректификацией;
- взаимодействием фенола и ацетона с образованием 4-изопропилфенола, который окисляют перекисью водорода в кислой среде с образованием гидрохинона и ацетона;
- окислением сернокислого анилина двуокисью марганца или хромовой кислотой до 4-бензохинона, затем восстанавливают 4-бензохинон порошкообразным железом в воде при 70—80 °С в присутствии гидросульфита натрия с общим выходом реакции 74—84 %.
Технические условия выпуска гидрохинона в СССР и Российской Федерации установлены ГОСТ 19627-74. В соответствии с ним выпускается два сорта реактива — высший и первый. Высший сорт выглядит как белый или серовато-белый порошок и содержит 99,5 % основного вещества, первый — как белый с желтоватым оттенком и содержит 99 % основного вещества.
Хотя при промышленном производстве обычно получают достаточно чистый реактив, но при необходимости можно получить большую степень очистки, перекристаллизовав продажный реактив из тщательно обескислороженной воды.
Оценка производственных мощностей США по производству гидрохинона составляла порядка 11,3 тыс. тонн в год (по состоянию на 1965 г.).
Применение
- в аналитической химии для определения pH и некоторых ионов металлов;
- в фотографии как проявляющее вещество;
- в производстве органических красителей, лекарственных средств, фотографических материалов как сырье;
- в производстве пищевых продуктов и каучуков как антиоксидант;
- в косметике используется в средствах для загара и как краска для волос;
- в косметической медицине для отбеливания кожи. Из-за канцерогенности его использование ограничено.;
- как ингибитор реакции полимеризации виниловых мономеров, в том числе для метилметакрилата, используемого в составе стоматологических композиционных материалов химического отверждения.
Применение в аналитической химии
- фотометрическом определении ниобия и вольфрама;
- титриметрическом определении ионов золота и цезия;
- при определении pH с использованием метода хингидронного электрода, для чего готовят хингидрон в виде эквимолярной смеси хинона и гидрохинона.
Применение в фотографии
Как единственное проявляющее вещество обычно применяется только в специальных проявителях, предназначенных для получения высокой оптической плотности, например для целей репродуцирования или полиграфии, либо для получения коричневой окраски на бромосеребряных фотобумагах.
Составы с гидрохиноном чувствительны к изменениями температуры: оптимальной является 18 °C, при 19 °C скорость работы нормальная, но уже при 20 °C начинается вуалирование; при снижении температуры до 10 °C проявление практически останавливается и при достижении 5 °C прекращается полностью.
Обычно применяется в проявителях вместе с метолом или фенидоном, при этом вуалирующая способность, присущая гидрохинону, исчезает.
Правовой статус
По состоянию на 2006 год известно о запрете лекарственных препаратов в Нигерии, содержащих более 5 % гидрохинона, из-за их нецелевого использования, а также о существовании в Германии ограничений на использование препаратов с гидрохиноном, где они могут применяться только для случаев патологической пигментации и не могут применяться для детей и подростков младше 12 лет.
Биологическая роль
Обладает слабым дезинфекционным действием, аналогичным тому, который оказывает фенол.
Безопасность
Токсичен. LD50 составляет 302 мг/кг (крысы, перорально). При попадании в организм окисляется до 4-бензохинона, превращающего гемоглобин в метгемоглобин. Может вызывать поражение глаз — конъюнктивит, и кожи — дерматит. ПДК для аэрозоля составляет 2 мг/м 3 . Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 1. Подтверждена канцерогенность для животных с неизвестной релевантностью для человека.
Напишите уравнения реакций получения из бензола пирокатехина гидрохинона
Опубликовано 12.06.2017 по предмету Химия от Гость >>
Ответ оставил Гость
Правда, я не очень уверена,что так.. а если нужно в одну реакцию,то тем более не знаю. а пара-дихлорбензол можно получить тем же способом,что и орто-,только хлор встанет в другом положении
http://chem.ru/gidrohinon.html
http://www.shkolniku.com/himiya/task1562947.html





