Напишите уравнения реакций получения нитрида и его
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи в молекуле аммиака.
Упражнение 2 Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Физические свойства аммиака.
Аммиак ― бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде.
Водный раствор аммиака используется в медицине и в быту под названием аммиачная вода, а 10%-ный раствор аммиака в воде более известен под названием нашатырный спирт. Аммиак используется в качестве хладагента в промышленных холодильных установках, т.к. легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.
Химические свойства аммиака.
1. Водный раствор аммиака изменяет окраску индикатора, т.к. гидрат аммиака – слабый электролит, он незначительно диссоциирует на катион аммония и гидроксид-анион:
NH3•H2O ⇄ NH4 + + OH —
2. Горит в избытке кислорода, при этом образуется азот и водяные пары:
4HN3 + 3O2 = 2N2 + 6H2O
3. Восстанавливает металлы с их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Схема окислительно-восстановительной реакции.
N -3 H3 + Cu +2 O → N2 0 + Cu 0 + H2O
2N -3 -6ē → N2 0 |6|6|1 ― процесс окисления
Cu +2 +2ē → 2Cu 0 |2| |3 ― процесс восстановления
В приведённой реакции аммиак (за счёт атомов азота в степени окисления -3) — восстановитель.
4. Водный раствор аммиака реагирует с кислотами, образуя соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак ― исходное вещество для солей аммония, которые используют в качестве удобрений (фосфаты, хлорид, нитрат аммония), как компоненты взрывчатых веществ (нитрат аммония или аммиачная селитра), в пищевой промышленности (гидрокарбонат, карбонат, хлорид аммония), при выделке кож и (сульфат аммония).
Упражнение 3 Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя? В аммиаке атом азота обладает минимальной степенью окисления (-3), поэтому он проявляет только восстановительные свойства.
Упражнение 4 В чём состоит донорно-акцепторный механизм образования ковалентной связи? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Донорно-акцепторный механизм образования ковалентной связи состоит в том, что связь формируется за счёт неподелённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Например, образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (она называется неподелённой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Первый атом называется донором, а второй ― акцептором. 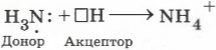
Какой ещё механизм образования ковалентной связи вам известен? Обменный механизм образования ковалентной связи. Например, образование молекулы хлороводорода.
Упражнение 5 Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
NH4 + + OH — = NH3↑ + H2O
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой.
6Na + N2 = 2Na3N
Na3N + 3H2O = 3NaOH + NH3↑
Какая из этих реакций является окислительно-восстановительной?
Реакция получения нитрида натрия, т.к. в ходе химического превращения происходит изменение степени окисления атомов элементов натрия и азота:
6Na + N2 = 2Na3N
Схема окислительно-восстановительной реакции.
Na 0 + N2 0 ⟶ Na3 +1 N -3
Восстановитель Na 0 — 1ē ⟶ Na +1 |1|6|6 ― процесс окисления
Окислитель N2 0 + 6ē ⟶ 2N -3 |6| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы натрия и азота. Находим наименьшее общее кратное для чисел 1 и 6 . Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 6, записываем результат за третьей чертой в строках, касающихся элементов натрия и азота. Множители 6 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 6 перед формулой натрия Na и коэффициент 1 (который обычно не пишем) перед формулой азота N2. Подбираем коэффициенты для остальных соединений.
Упражнение 2 С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
NH3 + HNO3 = NH4NO3
4NH3 + 3O2 = 2N2 + 6H2O
NH3 + H2O ⇄ NH4OH
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Упражнение 3 В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Распознать хлорид аммония можно с помощью щелочи NaOH. В пробирке с раствором хлорида аммония выделяющийся аммиак обнаруживают по запаху или посинению влажной красной лакмусовой бумаги. В пробирке с хлоридом натрия никаких изменений не наблюдаем.
Ответ подтвердите уравнениями соответствующих реакций.
NH4Cl + NaOH = NaCl + H2O + NH3↑
NH4 + + Cl — + Na + + OH — = Na + + Cl — + H2O + NH3↑
NH4 + + OH — = H2O + NH3↑
Упражнение 4 В 150 мл воды растворили 67,2 л аммиака (н.у.). Рассчитайте массовую долю аммиака в полученном растворе.
Дано: V(H2O)=150 мл, V(NH3)=67,2 л
Найти: ω(NH3)-?
Решение
1. Вычисляем количество вещества аммиака объёмом 67,2 л по формуле: ʋ =V:VM, где VM=22,4 л/моль при н.у.
ʋ(NH3 )=V( NH3 ):VM=67,2 л : 22,4 л/моль=3 моль
2. Вычисляем массу аммиака в количестве вещества 3 моль по формуле: ʋ=m/M, где M=Mr г/моль.
M ( NH3 )=17 г/моль
m(NH3)= ʋ(NH3) • M(NH3)=3 моль • 17 г/моль=51 г
3. Рассчитываем массу воды:
m(H2O)=V(H2O)•ρ(H2O)=150 мл • 1 г/мл=150 г. Поскольку ρ(Н2О)=1 г/мл, то для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитываем массу раствора:
m(раствора)=m(H2O)+m(NH3)=150 г + 51 г = 201 г
5. Вычисляем массовую долю аммиака в полученном растворе:
ω( NH3 )= m ( NH3 ):m(раствора)•100%=51 г : 201 г • 100%=25,4%
Ответ: 25,4%
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1 Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония.
Mr(KNO3)=101, Mr(NH4NO3)=80, Mr(Ca(NO3)2)=164, Mr((NH4)2SO4)=132
ω1(N)=Ar(N):Mr(KNO3)=14:101=0,139, или 13,9%
ω2(N)=2•Ar(N):Mr(NH4NO3)=2•14:80=0,35, или 35%
ω3(N)=2•Ar(N):Mr(Ca(NO3)2)=2•14:164=0,171, или 17,1%
ω 4(N)=2•Ar(N):Mr((NH4)2SO4)=2•14:132=0,212, или 21,2%
ω 3(N) ω1(N) ω4(N) ω2(N)
Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения? Л учше всего использовать нитрат аммония, т.к. в нем наибольшее содержание азота (35%).
Нитрид натрия
| Нитрид натрия | |
|---|---|
| Систематическое наименование | Нитрид натрия |
| Традиционные названия | Азотистый натрий |
| Хим. формула | Na3N |
| Состояние | тёмно-серые кристаллы |
| Молярная масса | 82,98 г/моль |
| Плотность | 1,84 г/см³ |
| Энтальпия | |
| • образования | -3,6 кДж/моль |
| Рег. номер CAS | 12136-83-3 |
| Рег. номер EINECS | 235-232-3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрид натрия — бинарное неорганическое соединение металла натрия и азота с формулой Na3N, тёмно-серые кристаллы, реагирует с водой.
Содержание
Получение
- Пропускание аммиака через нагретый металлический натрий:
2NH3 + 6 Na → T 2Na3N + 3 H2
- Пропуская электрические разряды через металлический натрий в атмосфере азота:
N2 + 6 Na → 2Na3N
Физические свойства
Нитрид натрия образует тёмно-серые кристаллы ромбоэдрической сингонии.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://chem.ru/nitrid-natrija.html http://acetyl.ru/o/nna3n1.php |

