Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e25cf1d898b0bfd • Your IP : 85.95.188.35 • Performance & security by Cloudflare
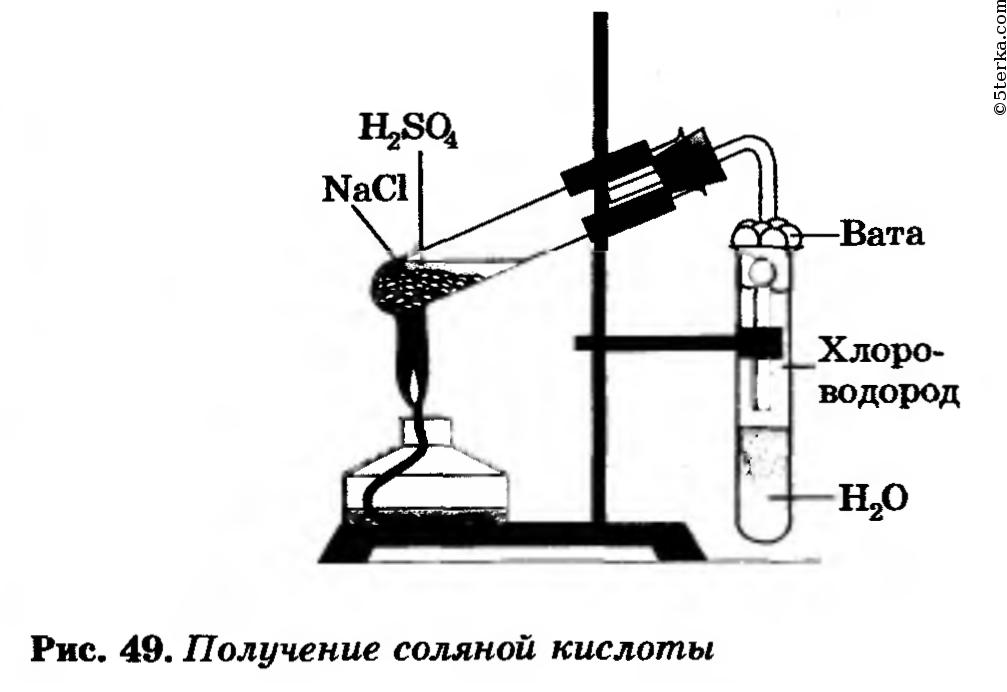
Практическая работа № 5(c). Получение соляной кислоты и изучение ее свойств
Получение соляной кислоты
Соберите прибор, как показано на рисунке 49.
В пробирку насыпьте 2—3 г хлорида натрия и прилейте столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды. Затем смесь в первой пробирке осторожно нагревайте в течение 5—6 мин (следите, чтобы кислоту не перебросило во вторую пробирку с водой!).
1. Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
2. Чем вызвано появление во второй пробирке тонких опускающихся вниз струек?
3. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Изучение свойств соляной кислоты
Полученную соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумажку. Во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку внесите немного оксида меди(П) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди(П), в шестую — немного мела или другого карбоната.
1. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составьте уравнения соответствующих реакций.
3. Проведите реакции по распознаванию соляной кислоты и ее солей. Для этого в одну пробирку налейте 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения проведенных вами реакций и укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра(1) можно также использовать раствор нитрата свинца(П)?
Ответы:
Получение соляной кислоты (HCl):
Изучение свойств соляной кислоты:
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций.

задача №5
к главе «Практические работы».
Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагреванииб)?
Химия | 5 — 9 классы
Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании
Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз?
а)При обычных условиях :
NaCl + H₂SO₄ ( концентрированная ) = NaHSO₄ + HCl ( хлороводород не выделяется )
При нагревании : t
H₂SO₄ (концентрированная) + NaCl = NaHSO₄ + HCl↑
б) Раствор хлороводорода немного тяжелее воздуха, поэтому мы можем наблюдать тонкие опускающие струйки ещё не перемешавшейся, только что образовавшейся при растворении соляной кислоты.
Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов : а) хлорида железа(3) и гидроксида натрия б) серной кислоты и гидроксида лития в) азотной кислоты и карбоната натр?
Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов : а) хлорида железа(3) и гидроксида натрия б) серной кислоты и гидроксида лития в) азотной кислоты и карбоната натрия.
Напишите уравнения реакций взаимодействия следующих веществ при нагревании : а) алюминия с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотойПОМОГИТЕ ПЖЛС : *?
Напишите уравнения реакций взаимодействия следующих веществ при нагревании : а) алюминия с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотой
Напишите уравнение реакций взаимодействия следующих веществ при нагревании : а) алюминий с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотой?
Напишите уравнение реакций взаимодействия следующих веществ при нагревании : а) алюминий с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотой.
Напишите уравнения реакций взаимодействия следующих веществ при нагревании а)алюминия с разбавленной серой кислотой б)серебра с концентрированной серной кислотой?
Напишите уравнения реакций взаимодействия следующих веществ при нагревании а)алюминия с разбавленной серой кислотой б)серебра с концентрированной серной кислотой.
Напишите уравнение реакций взаимодействия следующих веществ при нагревании : а)алюминия с разбавленной серной кислотой, б)серебра с концентрированной серной кислотой?
Напишите уравнение реакций взаимодействия следующих веществ при нагревании : а)алюминия с разбавленной серной кислотой, б)серебра с концентрированной серной кислотой.
Напишите уравнения реакций взаимодействия следующих веществ при нагревании :a) алюминия с разбавленной серной кислотойб) серебра с концентрированной серной кислотой?
Напишите уравнения реакций взаимодействия следующих веществ при нагревании :
a) алюминия с разбавленной серной кислотой
б) серебра с концентрированной серной кислотой.
Почему реакция между хлоридом натрия и серной кислотой не протекает в растворе?
Почему реакция между хлоридом натрия и серной кислотой не протекает в растворе.
Помогите?
Имеются три пронумерованные пробирки с бесцветными растворами.
Как можно определить в какой из них хлорид натрия, серная кислота, едкий натр?
Напишите уравнения реакций.
Уравнения химической реакции серной кислоты с хлоридом натрия?
Уравнения химической реакции серной кислоты с хлоридом натрия.
СРОЧНО?
Имеются три пронумерованные пробирки с бесцветными растворами.
Как можно определить в какой из них хлорид натрия, серная кислота, едкий натр?
Напишите уравнения реакций.
На этой странице находится ответ на вопрос Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагреванииб)?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
K2O — оксид калия (основные оксиды) BaO — оксид бария (основные оксиды) Al2(SO4)3 — сульфат алюминия (средние соли) NaHCO3 — гидрокарбонат натрия (кислые соли).
4P + 5O₂ = 2P₂O₅ P⁰ — 5e = P⁺⁵ 4 фосфор восстановитель, процесс окисления O₂ + 4e = 2O⁻² 5 кислород окислитель, процесс восстановления P₂O₅ + 3H₂O = 2H₃PO₄ P₂O₅ + 3H₂O = 2H⁺ + 2H₂PO₄⁻ H₃PO₄ + 3NaOH = Na₃PO₄ + 3H₂O H⁺ + H₂PO₄⁻ + 3Na⁺ + 3OH⁻ = 3Na⁺ + P..
Fe(OH)3 + 3HCl = FeCl3 + 3H2O n(Fe(OH)3) = 21. 4 / 107 = 0. 2моль по уравнению реакции n(HCl) в 3 раза больше n(fe(oh)3) n(hcl) = 0, 6 моль m = n * M m(hcl) = 0. 6 * 36. 5 = 21. 9г W = m(в — ва) / m(р — ра) m(р — ра) = m(в — ва) / W m(hcl)(ра — ..
HCl + H2O = H3O( + ) + Cl ( — ).
А) по уравнению при восстановлении 1моль оксида выделяется 80кДж теплоты , значит при восстановлении 5 моль = 80 * 5 = 400кДж б)1, 6г это 1, 6 / 64 = 0, 025моль оксида , теплоты будет 80 * 0, 025 = 2кДж.
Mr(SO3) = 32 + 3 * 16 = 80 W(S) = 32 / 80 = 0. 4 = 40% Mr(SO2) = 32 + 2 * 16 = 64 W(S) = 32 / 64 = 0. 5 = 50% В 0, 8 раза.
M(CuSO4) = 64 + 32 + 4 * 16 = 160 г / моль n(CuSO4) = 1. 6 / 160 = 0. 01 моль.
http://5terka.com/node/10692
http://himia.my-dict.ru/q/459815_napisite-uravnenia-himiceskih-reakcij-protekausih-mezdu/