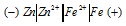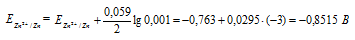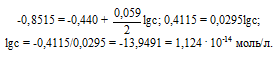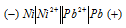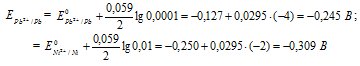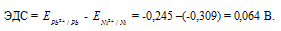Напишите уравнения реакций протекающих по схеме zn
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni 2+ ] = 0,01 моль/л, [Pb 2+ ] = 0,0001 моль/л.
А(-) Ni|Ni 2+ || Pb 2+ |Pb (+)К
А: Ni ⟶ Ni 2+ + 2e
К: Pb 2+ + 2e ⟶ Pb
Суммарный процесс: Ni + Pb 2+ ⟶ Ni 2+ + Pb
`»ЭДС» = E_(«Pb»^(2+)»/Pb») — E_(«Ni»^(2+)»/Ni») = E_(«Pb»^(2+)»/Pb»)^0 — E_(«Ni»^(2+)»/Ni»)^0 + 0.0295*»lg»([Pb^(2+)])/([Ni^(2+)]) = -0.127 — (-0.25) + 0.0295*»lg»0.0001/0.01 = 0.064 В`
Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Железо, потенциал которого (-0,440 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe 2+ , если электродный потенциал железного электрода равен -0,8515 В, получим:
Ответ: сFe 2+ = 1,124 . 10 -14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb 2+ ] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см 3 ). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H + + 2SO4 2- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O — 2 
Катод: PbSO4 + 2 
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb 2+ + SO4 2- — 2 
Катод: PbO2 + 4H + + SO4 2- + 2 
При разрядке аккумулятора:
К(+): PbO2 + 4H + + 2 
А(-): Pb 0 → Pb 2+ + 2
При зарядке аккумулятора:
К(+): Pb 2+ + 2 
А(-): Pb2+ + 2H2O → PbO2+4H + + 2
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH — → NiOOH + H2O + 1 
К(-): Cd(OH)2 + 2 
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 
А(-): Cd + 2OH — → Cd(OH)2 + 2 
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni 2+ → Ni 3+ + 1 
К: Fe 2+ + 2 
При разрядке аккумулятора:
А: Fe 0 → Fe 2+ + 2 
К: Ni 3+ + 1 
Напишите уравнения реакций согласно схеме превращений. Укажите Х1 и Х2. Дайте названия продуктам реакций. Zn(OH)2 → ZnO → Zn
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://buzani.ru/zadachi/khimiya-shimanovich/941-akkumulyatory-eds-elementa-zadaniya-1-4
http://www.soloby.ru/994697/%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%81%D0%BE%D0%B3%D0%BB%D0%B0%D1%81%D0%BD%D0%BE-%D0%BF%D1%80%D0%B5%D0%B2%D1%80%D0%B0%D1%89%D0%B5%D0%BD%D0%B8%D0%B9-%D0%BD%D0%B0%D0%B7%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F-%D0%BF%D1%80%D0%BE%D0%B4%D1%83%D0%BA%D1%82%D0%B0%D0%BC