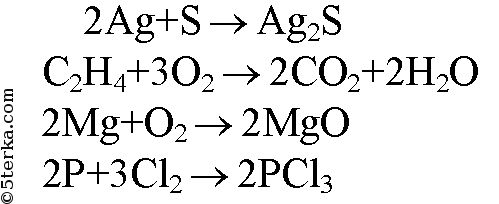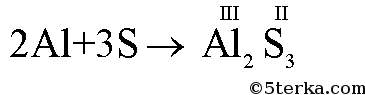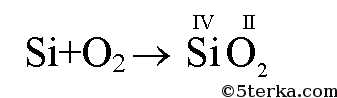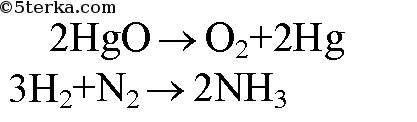Тема I. Работа 4. Химические уравнения. Вариант 3
Вопросы:
1. Расставьте коэффициенты в схемах реакций. а) Ag + S → Ag2S в) Mg + O2 → MgO б) С2H4 + O2 → СO2 + H2O г) Р + С12 → РС13
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
а) Al + S II → AlS б) Si + O2 → SiO
3. Перепишите приведенные схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты. а) HgO → O2 + ? б) ? + N2 → NH3
Решения и ответы:

задача №3
к главе «Тема I. Первоначальные химические понятия. Работа 4. Химические уравнения».
Подбор коэффициентов в уравнениях реакций методом полуреакций
Составление уравнений электронного баланса
Задача 121.
Составьте уравнение электронного баланса, расставьте коэффициенты в уравнениях реакций, подберите коэффициенты методом полуреакций в следующих уравнениях:
1) NaNO3 + Mg + H2О = NH3 + Mg(OH)2 + NaOH
2) Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
3) H2S + K2CrO7 + H2SO4 = S + Cr2(SO4)3 + K2SO4 + H2O
Решение:
1) NaNO3 + Mg + H2О= NH3 + Mg(OH)2 + NaOH
Уравнения электронного баланса:
Восстановитель 4|Mg 0 — 2электрона = Mg 2+ процесс окисления
Окислитель 1|N 5+ + 8электронв = N 3+ процесс восстановления
4Mg 0 + N 5+ = 4Mg 2+ + N 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 8. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Mg – восстановитель, окислитель – NaNO3; Mg окисляется до Mg(OH)2, NaNO3 – восстанавливается до NH3.
2) Na2SO3 + KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Уравнения электронного баланса:
Восстановитель 1|S 4+ — 2электрона = S 6+ процесс окисления
Окислитель 2|Mn 7+ + 1электрон = Mn 6+ процесс восстановления
S 4+ + 2Mn 7+ = S 6+ + 2Mn 6+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 2. Разделив это число на 1, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 2 на 2 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, окислитель – KMnO4; Na2SO3 окисляется до Na2SO4, KMnO4 – восстанавливается до K2MnO4.
Уравнения электронного баланса:
Восстановитель 3|S 2– — 2электрона = S 0 процесс окисления
Окислитель 2|C r6+ + 3электрона = Cr 3+ процесс восстановления
3S 2- + 2Cr 6+ = 3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Формулы амфотерных солей
Задача 122.
Составьте формулы всех солей соответствующих кислотам и основаниям,
приведенным для вашего задания. (Для амфотерных гидроксидов необходимо составить формулы их солей, образованных как при реакции с кислотами,
так и с основаниями). Приведите реакцию получения одной из солей в молекулярной и сокращенной ионно-молекулярной форме.
NH4OH; Mg(OH)2; HI; H3BO3.
Решение:
1. Для NH4OH:
NH4Cl, (NH4)2SO4, NH4NO3.
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O — молекулярная форма;
2ОН – + 2Н + = 2H2O — сокращенная ионно-молекулярная форма.
4B(OH)3 + 2NaOH = Na2B4O7 + 7H2O — молекулярная форма;
7ОН – + 7Н + = 7H2O — сокращенная ионно-молекулярная форма.
http://buzani.ru/zadachi/obshchaya-khimiya/1699-koeffitsienty-v-uravneniyakh-reaktsij-zadachi-121-122