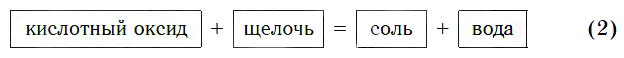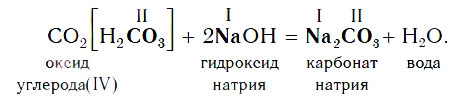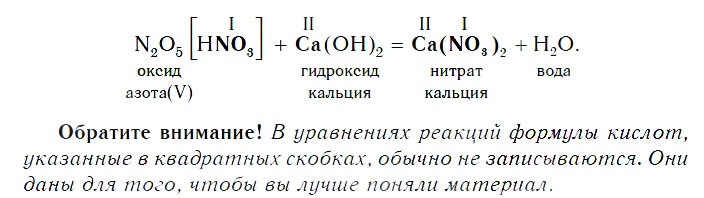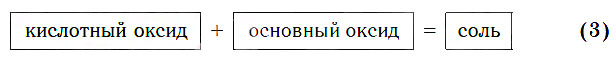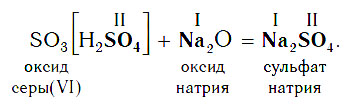Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например , оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например , ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например , твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Например , оксид серы (IV) окисляется кислородом до оксида серы (VI):
Урок 32. Химические свойства оксидов
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
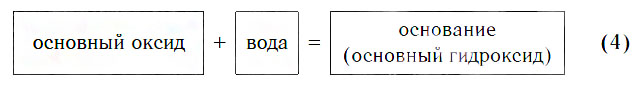
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Напишите уравнение реакции кислотного оксида с щелочью SO3 + KOH = N2O5 + NaOH = CO2 + Ca(OH)2 = SiO2 + KOH =?
Химия | 5 — 9 классы
Напишите уравнение реакции кислотного оксида с щелочью SO3 + KOH = N2O5 + NaOH = CO2 + Ca(OH)2 = SiO2 + KOH =.
1)SO3 + 2 KOH = K2SO4 + H2O
2)2NaO + N2O5 = 2NaNO3 + H2O
3)CO2 + Ca(OH)2 = CaCO3 + H2O 4)SIO2 + 2KOH = K2SIO3 + H2O.
Напишите уравнения химических реакций, с помощью которых можно получить соли : кислотный оксид + щелочь?
Напишите уравнения химических реакций, с помощью которых можно получить соли : кислотный оксид + щелочь.
Al2O3 + KOH — реакция пойдет?
Al2O3 + KOH — реакция пойдет?
, если да, то напишите уравнение.
Из 2 — ух приведенных ниже реакций идёт только одна?
Из 2 — ух приведенных ниже реакций идёт только одна.
Напишите уравнение реакции.
Почему NaOH KOH называют едкими щелочами?
Почему NaOH KOH называют едкими щелочами?
Реакции между алюминием и растворами кислот (HCl, H2SO4) и щелочей (NaOH, KOH)?
Реакции между алюминием и растворами кислот (HCl, H2SO4) и щелочей (NaOH, KOH).
Напишите полные и сокращённые ионные уравнения реакций между растворами электролитов : а)JUSt + NaOH = б)HNO3 + KOH = в)CuSO4 + NaOH =?
Напишите полные и сокращённые ионные уравнения реакций между растворами электролитов : а)JUSt + NaOH = б)HNO3 + KOH = в)CuSO4 + NaOH =.
Какие в — ва вступают в реакцию нейтрализации?
Какие в — ва вступают в реакцию нейтрализации?
Напишите уравнение этих реакций.
H3PO4, KOH, NaOH, HCL.
Сделать ионообменные реакции : Ca(NO₃)₂ + KOH = CaOH + K(NO₃)₂?
Сделать ионообменные реакции : Ca(NO₃)₂ + KOH = CaOH + K(NO₃)₂.
Составьте уравнения реакций, пожалуйста) H2SiO3 + KOH = SiO2 + NaOH = MgSO4 + CaOH =?
Составьте уравнения реакций, пожалуйста) H2SiO3 + KOH = SiO2 + NaOH = MgSO4 + CaOH =.
Напишите молекулярные полные и сокращенные ионные уравнения химических реакций А)NaOh + KNO3 B)H2So4 + KOH?
Напишите молекулярные полные и сокращенные ионные уравнения химических реакций А)NaOh + KNO3 B)H2So4 + KOH.
Вопрос Напишите уравнение реакции кислотного оксида с щелочью SO3 + KOH = N2O5 + NaOH = CO2 + Ca(OH)2 = SiO2 + KOH =?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Щелочноземельный металл. Валентность II Значит формула сульфата щелочноземельного металла будет MeSO4 формула для нахождения массовой доли элемента будет : W = nAr / Mr n — число атомов элементов в молекуле Ar — атомная масса элемента Mr — молекуляр..
Формула МеSO4 Пусть масса соединения 100г Тогда масса серы — 100 * 0. 266 = 26. 6 г Моль серы = 26. 6 / 32 = 0. 83 моль Моль О = 0. 83 * 4 = 3. 32 моль Масса О = 3. 32 * 16 = 53. 12 г Масса металла = 100 — 53. 12 — 26. 6 = 20. 28 г Моль ме..
Cl2 + 2H2O + SO2→ 2HCl + H2SO4. CL2(0) + 2e = 2CL( — ) 1 окислитель процесс восстановления S( + 4) — 2e = S( + 6) 1 восстановитель процесс окисления.
2cu + o2 = 2cuo или 2h2 + o2 = 2h2o 4li + o2 = 2li2o 4al + 3o2 = 2al2o3 минимально возможная сумма коэффициентов 3 два реагента и один продукт например c + o2 = co2 или s + o2 = so2 конечно сумма коэффициентов может быть четной например na2o + h2o = ..
Cl₂ Br₂ I₂ F₂ Вроде бльше нет Всегда пишутся отдельно так, если ввещ — ве, например Ca²⁺Cl₂⁻ то здесь двойка из — за степени окисления кальция.
1. m(в — ва) = m(р — ра) * n = 450 * 20% = 90 грамм m(H2O) = m(р — ра) — m(в — ва) = 450 — 90 = 360 грамм 2. 90 + 30 = 120грамм (в — ва(2)) 360 + 120 = 480грамм (раствора(2)) n = m(в — ва(2)) / m(раствора(2)) = (120 / 480) * 100% = 25%.
Ответ 3 Fe3(PO4)2 Mr = 3Fe + 2P + 😯 = 168 + 62 + 16 * 8 = 358 w (3Fe) = m элемента / m вещества = 168 / 358 = 0. 47 = 47% w(2P) = 0. 17 = 17% w(8O) = 0. 36 = 36%.
Азотная кислота — HNO3 Серная кислота — H2SO4.
ZnCl2 + Na2S = ZnS + 2NaCl.
1. C4H8 + H2 = C4H10 Бутен + водород = бутан 2. C4H10 + Cl2 = C4H9Cl + HCl Бутан + хлор = хлорбутан + хлороводород 3. 2C4H9Cl + 2Na = C8H18 + 2NaCl Хлорбутан + натрий = октан + хлорид натрия 4. C8H18 + 12. 5O2 = 8CO2 + 9H2O Октан + кислород = угл..
http://himi4ka.ru/arhiv-urokov/urok-32-himicheskie-svojstva-oksidov.html
http://himia.my-dict.ru/q/4213701_napisite-uravnenie-reakcii-kislotnogo-oksida-s/