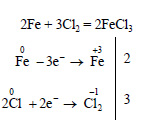Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2553f11ce47b77 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте уравнения реакций железа с простыми и сложными веществами Покажите переход электронов и поясните, что окисляется и что восстанавливается, что является окислителем и что восстановителем.
Окислителем является хлор, восстановителем – железо.
Окислителем является водород, восстановителем – железо.
Окислителем является свинец, восстановителем – железо.

задача №16
к главе «Глава V. Металлы».
Семинар по теме: «Железо и его соединения»
Разделы: Химия
Задачи урока: Повторить, закрепить и провести коррекцию знаний основных теоретических вопросов темы “Железо и его соединения”, провести тренинг по составлению уравнений химических реакций с целью совершенствовать эти умения, закрепить теоретические знания практическим путем. Провести контроль усвоения основных теоретических понятий.
Оборудование и реактивы: кодоскоп; для демонстрационных опытов: растворы FеSO4, FеС12, FеС13, NаОН, НСl, К3[Fе (СN)6], К4[Fе(СN)6], КСNS, пробирки.
Подготовка к семинару: учащимся заранее выдаются вопросы к семинару
1. Постановка задачи. Организационный момент.
2. Работа по вопросам семинара.
1 вопрос: Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо в соединениях? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
Валентные электроны 4S и 3d
Степени окисления +2 и +3
2 вопрос: В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
В земной коре железа 5,1% (это 2 место после Аl) .
В основном в виде соединений: оксидов, сульфидов, карбонатов.
Магнитный железняк Fе3О4 (Урал)
Гидрокарбонат железа (II) Fе (НСОз)2 (Железноводск)
В свободном виде встречается только в метеоритах.
3 вопрос: Каковы физические свойства железа?
Ответ: серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см 3 ; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество, обладает магнитными свойствами.
4 вопрос: С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
2) 2Fе + 3Сl2 = 2FеС13 — хлорид железа (III)
3) Fе + S = FеS — сульфид железа (II)
Образование ржавчины: 4Fе + 3О2 + 6Н2О = 4Fе(ОН)з
5 вопрос: С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
1) с водой при нагревании 3Fе + 4Н2О = Fе3О4 + 4Н2 
2) с растворами кислот Fе + 2НС1 = FеС12 + Н2 
Fе + 4HNOз (разб.) = Fе(NOз)з + NО 
3) c концентрированными кислотами HNOз и H2SО4 при обычной температуре железо пассивируется;
при нагревании: 2Fе + 6H2SО4(конц.) = Fе2(SО4)3 + 3SО2 
Fе + 6HNOз (конц.) = Fе(NOз)з + 3NО2 
4) с растворами солей менее активных металлов
Fе + СuSО4 = FеSО4 + Сu (сульфат железа (II), медь)
6 вопрос: Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Ответ: Fе(ОН)2 — основание и Fе(ОН)3 — более слабое основание (амфотерное)
| Fе (ОН)2 + 2НС1 = FеСl2 + 2Н2О Fе (ОН)2 + NаОН | Fе (ОН)3 + 3НС1 = FеСl3 + 3Н2О Fе (ОН)3 + NаОН = Nа[Fе(ОН)4] |
7 вопрос: Почему гидроксид железа (II) со временем становится бурым?
Ответ: Соединения Fе +2 нестойки и со временем на воздухе окисляются до Fе +3 :
4 Fе (ОН)2 + О2 + 2 Н2О = 4 Fе (ОН)з  | |
8 вопрос: Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Ответ (сопровождается демонстрационными опытами).
9 вопрос : Какова биологическая роль железа и его соединений?
Примерный ответ: Железо — это биогенный элемент. Он входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке. В организме взрослого человека имеется 4-5 г железа, из них 65% — в крови. Железо стимулирует функцию кроветворных органов. Красный пигмент крови – гемоглобин – осуществляет перенос кислорода от органов дыхания к тканям и обратный перенос углекислого газа от тканей к легким.
Много железа содержится в коровьем и козьем молоке, яичном желтке.
У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие).
3. Выполнение упражнений.
Упр.1: Составьте уравнения реакций к схеме:
Выполнение:
- 4Fе + 3О2 = 2Fе2О3
- Fе2О3 + 6НС1 =2FеС13 + 3Н2О
- 2FеС13 + 3Аg2SО4 = Fе2(SО4)3+ 6 AgCl
- Fе2(SО4)3 + 6NаОН = 2Fе(ОН)3
+ 3Nа2SО4
- Fе(ОН)3 + КОН = К [Fе(ОН)4]
- FеС13 + 3NаОН = Fе(ОН)3
+ 3NаСl
- Fе(ОН)3 + 3НС1 = FеС13 + 3Н2О
- Fе2О3 + 6НС1 = 2FеС13 + 3Н2О
- 2Fе(ОН)3 = Fе2О3 + 3Н2О
Упр. 2: Методом электронного баланса составьте уравнения, протекающие по схемам:
4. Задача: На сколько граммов увеличится масса железной пластинки, опущенной в раствор СиS04, если при этом на пластинке оказалось 20,8 г металлической меди?
Х = 18,2 г железа растворилось => m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г
5. Подведение итогов урока. Оценки учащимся.
http://5terka.com/node/142
http://urok.1sept.ru/articles/414045