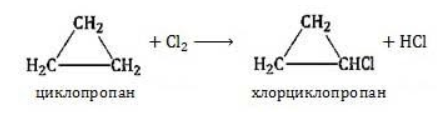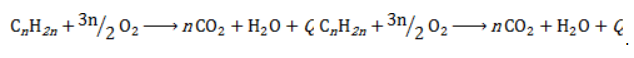Химические свойства циклоалканов
Количество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам.
Реакции присоединения
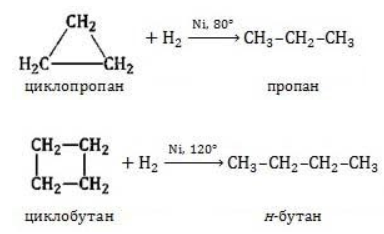
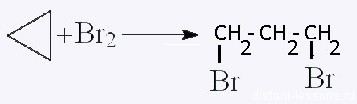
Участие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану 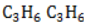
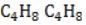
Гидрирование
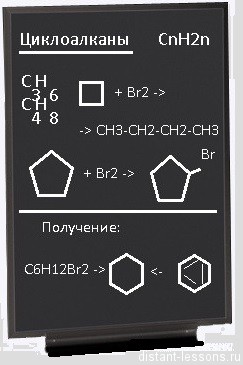
Условиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана:
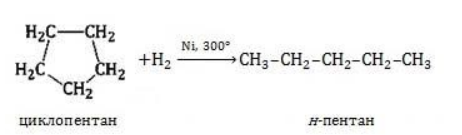
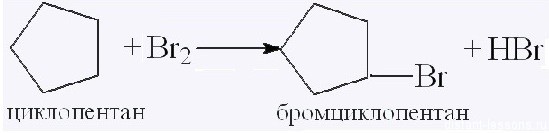
Для вступления в реакцию циклопентана требуются более жесткие условия:
Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения.
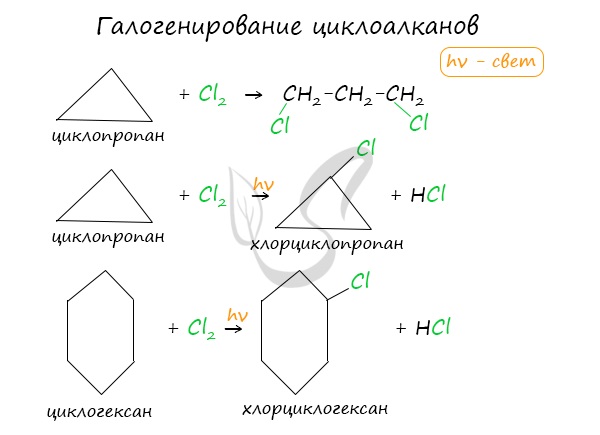
Галогенирование
Продуктом этой реакции становится дигалогеналкан:
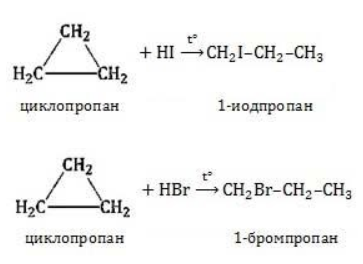
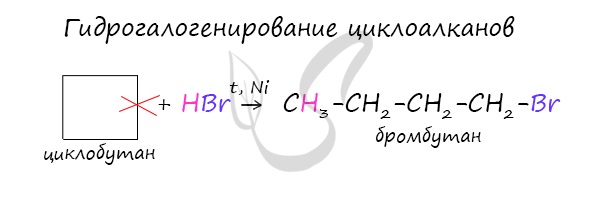
Гидрогалогенирование
Циклопропан реагирует в водном растворе с галогенводородами:
Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода:
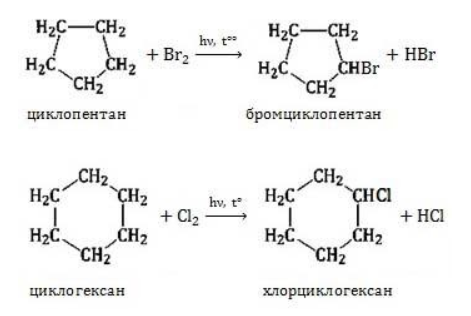
Реакции замещения
Для циклоалканов со слабо напряженным или ненапряженным циклом (
Галогенирование
В результате реакции образуется галогенциклоалкан:
Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C:
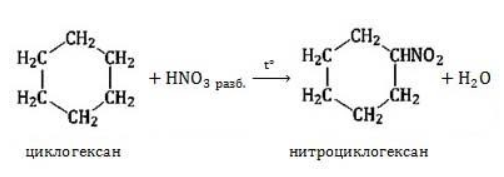
Нитрование
Азотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан:
Окисление циклоалканов
Реакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором 
Мягкое окисление
При мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт):
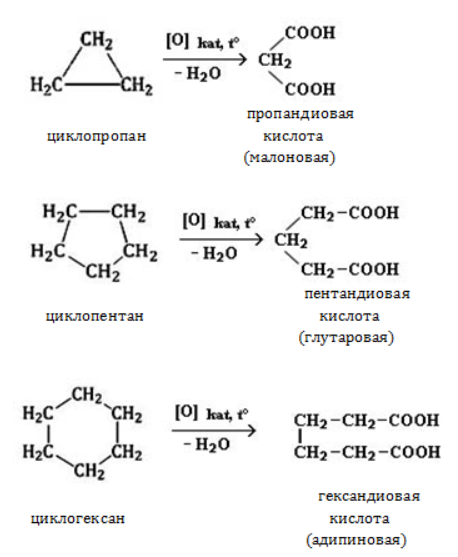
Жесткое окисление
С использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях:
Полное окисление (горение)
В общем виде уравнение горения циклоалканов записывается:
Инициирует реакцию контакт с открытым пламенем.
Реакция отщепления
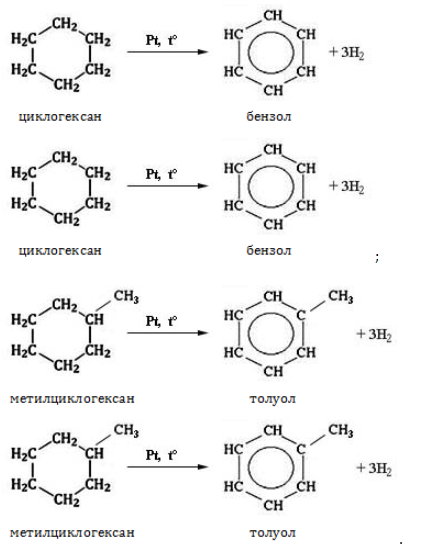
Нагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда:
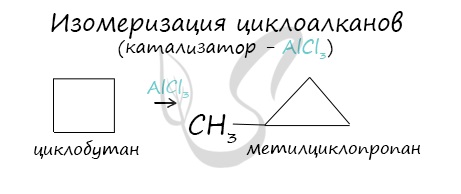
Изомеризация
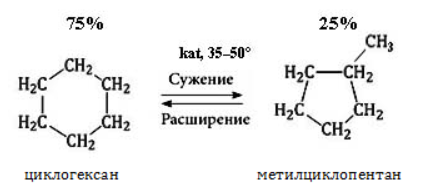
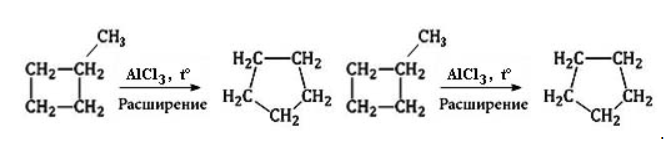
Циклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью:
Реакция идет в обоих направлениях до установления равновесия.
Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо:
Заключение
Циклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений.
Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей.
Химия, Биология, подготовка к ГИА и ЕГЭ
Свойства циклоалканов
Циклоалканы — интересные вещества. С одной стороны, они насыщенные, т.к. связь С-С — одинарная, с другой стороны, общая формула у них как у алкенов — CnH2n. Помимо этого, внутри гомологического ряда есть вещества, имеющие немного разные химические свойства…
Общая формула циклоалканов:
n = числу атомов углерода.
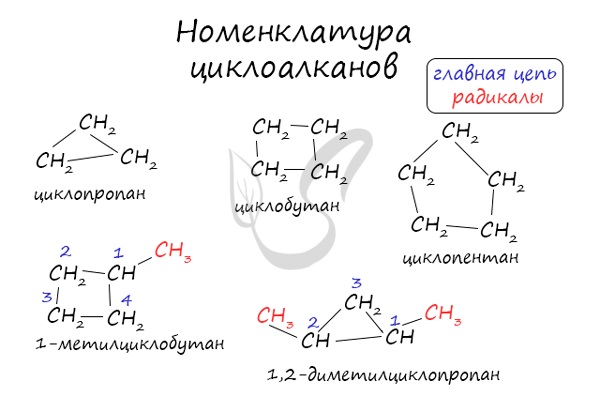
Название углеводородов строятся из двух частей.
Первая часть «говорит» о том, что это циклические соединения — «цикло-«, вторая — название самого алкана по количеству атомов углерода, с традиционным для алканов окончанием -ан.
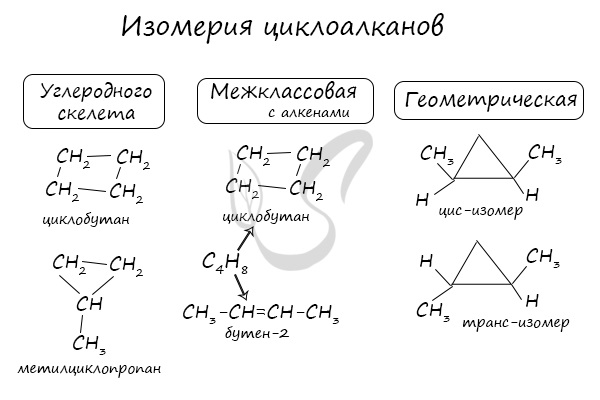
Изомерия циклоалканов
Структурная и межклассовая — циклоалканы изомерны алкенам
(есть еще пространственная, но в школьном курсе ее не затрагивают)
Химические свойства циклоалканов:
Вот тут-то мы и поговорим о «внутренних противоречиях»:
первые члены гомологического ряда — циклопропан (с меньшим количеством атомов углерода уже не может быть) и циклобутан имеют довольно маленькие углы между связями — у циклопропана — 60°, у циклобутана — 90°. (Для сравнения — у алканов — 109°28’, у алкенов — 120) Поэтому эти соединения неустойчивы в цикле — при первой же возможности они становятся производными алканов:
Гидрирование: C3H6 + H2 = C3H8 — реакция похожа на реакции алкенов
Галогенирование:
Гидрогалогенирование — аналогично.
Циклоалканы с большим количеством атомов углерода вступают в реакции замещения:
Это реакция замещения — характерная реакция алканов
Реакции окисления: цикл разрывается и по концам образуется группа -COOH:
C5H10 + [O] → HOOC-(CH2)3-COOH
(циклопропан и циклобутан устойчивы к окислению)
Горение: все как обычно — все органические веществ сгорают с образованием CO2 и H2O:
СnH2n + 3n\2 O2 = nCO2 + nH2O
В общем, если подвести итог, то картина такая:
- циклоалканы с небольшим числом атомов углерода: 3 и 4 вступают в реакции присоединения с раскрытием цикла;
- циклоалканы с большим числом атомов углерода вступают в реакции замещения
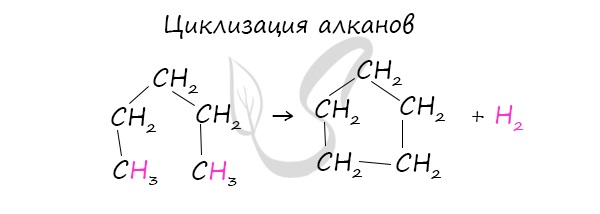
Получение циклоалканов:
- из линейных соединений — алканов:
Запомните правило — циклизация любых линейных соединений состоит из этапов:
1) активация цепи с двух концов: СH2Cl — CH2 — CH2Cl
2) замыкание в цикл дегалогенированием: СH2Cl — CH2 — CH2Cl + Zn = C3H6 + ZnCl2
- из ароматических соединений гидрированием: С6H6 +3H2 = С6H12
- в ЕГЭ это вопрос А13 и А14— Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2— Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Циклоалканы
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://distant-lessons.ru/ximiya/cikloalkany
http://studarium.ru/article/182