Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
Второе начало термодинамики. Энтропия.
Второе начало термодинамики:теплота не может переходить от менее нагретого тела к более нагретому телу.
Энтропия S — отношение теплоты к температуре, при которой происходит переход энергии S = Q/T Дж/моль К.
Энтропия по Больцману : S = k · ln W,где W — вероятность состояния данной системы,
k – const Больцмана. 

Энтропия зависит от:
Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию. Изотопного состава. Молекулярной массы однотипных соединений. Строения молекулы. Кристаллической структуры.
Существует примерно 40 формулировок 2-го закона термодинамики:
1. Постулат Клаузиуса (немец Рудольф Клаузиус). «Единственным результатом любой совокупности процессов не может быть переход теплоты от тела менее нагретого к более нагретому.»
2. Постулат Томсона Кельвина. Процесс, единственным результатом которого является превращение теплоты в работу, невозможен.
3. В изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энергии.
В самопроизвольном процессе DS > 0 (обладают все реальные системы)
В равновесном процессе DS = 0;
В не самопроизвольном процессе DS 0 298 кДж/моль ΔG 0 298 = ΔH 0 298– TΔS 0 298
При ΔG 0 указывает на то, что процесс термодинамически запрещен.
Если ΔH 0, то всегда ΔG
Если ΔH > 0 и ΔS 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS.
Для оценки знака ΔG реакции важно знать величины ΔH и ΔSнаиболее типичных процессов. ΔH образования сложных веществ и ΔH реакции лежат в пределах 80–800 кДж∙моль -1 . Энтальпия реакции сгорания 


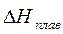
Функции F и G — надежный критерий оценки возможности, направления и пределов протекания естественных процессов в неизолированных системах.
уравнение Гиббса — Гельмгольца: 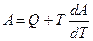

Энергия Гиббса. Энергия Гельмгольца. Направление процесса.
Чтобы дать ответ на вопрос о возможности протекания той или иной реакции, о ее направлении и глубине необходимо снова воспользоваться II – законом термодинамики, который может быть сформулирован следующим образом: любой самопроизвольно протекающий процесс, а также и химическая реакция, идет в том направлении, которое сопровождается уменьшением свободной энергии в системе (при постоянных температуре и давлении) или энергии Гельмгольца (при постоянных температуре и объеме).
Свободная энергия или Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы.
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы.
При протекании химических реакций единовременно совершаются два направления: стремление простых частиц объединиться в более сложные, а также стремление сложных частиц к распаду на более простые.
Они не зависят друг от друга и их величины противоположны, и процесс идет в сторону той реакции, при которой изменение величины больше. Разность между этими величинами определяет свободную энергию реакции (при постоянных температуре и давлении). Ее изменение в реакции определяется разностью сумм энергий Гиббса конечных продуктов реакции и исходных веществ:
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией следующим выражением:
Здесь изменение энергии Гиббса учитывает одновременно изменение энергетического запаса системы и степень ее беспорядка (самопроизвольность протекания процесса).
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
- Если ΔG отрицательно (ΔG 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Энтальпийный и энтропийный факторы и направление процесса
Выясним, как функция свободной энергии зависит от изменений энтропии и энтальпии идущего процесса. Вернемся к выражению, связывающему энергию Гиббса с энтальпией и энтропией:
Без энтропийных факторов все экзотермические реакции (ΔH˂0) должны были быть самопроизвольными. Но энтропийный фактор, который определяется величиной – TΔS, может привести к росту или, наоборот, к падению способности самопроизвольного протекания.
Так, при ΔS>0, член – TΔS вносит отрицательный вклад в общую величину ΔG, следовательно он повышает возможность реакции протекать самопроизвольно.
А при при ΔS 0 Изменение энергии Гиббса. Для удобства принято сравнивать значения ΔG при стандартных условиях – концентрации равны 1 моль/л, парциальное давление газообразных веществ равно 101,3 кПа, температура 298,15 К. Тогда свободную энергию обозначают через ΔG 0 , на основе значений которой можно вычислить изменение энергии Гиббса химической реакции: Величина ΔG 0 р-ции позволяет определить, будет ли данная реакция, находящаяся в стандартных условиях, протекать самопроизвольно в прямом или обратном направлении. Аналогично теплоте образования, энергии Гиббса образования простых веществ равны нулю. Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением: Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением: ΔA — величина, которая не зависит от пути, а зависит только от исходного и конечного состояния системы, т.е. ΔA также, как и другие рассмотренные термодинамические величины, является функцией состояния. Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых А уменьшается. Таким образом, при ΔA 0 – в обратном направлении, а при ΔA=0 система находится в состоянии равновесия. Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия: Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура. Если K>>1, т.е. реакция идет в прямом направлении, то ΔG 0 ˂˂0. Если K 0 >>0 Если K=1, то ΔG 0 =0 В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG 0 можно связать с ЭДС гальванического элемента следующим соотношением: ΔG 0 =-nFE 0 , где nF – количество прошедшего электричества E 0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии. При самопроизвольном протекании процесса, его ΔG 0. Порог реакционной способности веществ для большинства реакций имеет значение ΔG 0 ≈41 кДж/моль. То есть, если ΔG 0 0 >+41 кДж/моль, то процесс неосуществим в любых реальных и стандартных условиях. 2.3. Энергия Гиббса, энергия Гельмгольца и направленность химических реакций Энергия Гиббса химических реакций. Как и ранее рассмотренные термодинамические функции, энергия Гиббса является функцией состояния. При переходе системы из одного состояния в другое изменение ее величины не зависит от пути протекания процесса, а лишь от природы исходных и конечных веществ и их состояний. Поэтому энергию Гиббса химической реакции DrG° можно рассчитать через стандартные энергии Гиббса образования веществ, используя следствие из закона Гесса. Энергия Гиббса реакции равна сумме энергий Гиббса образования продуктов за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. В результате протекания химической реакции (2.13) энергия Гиббса рассчитывается по формуле Например, энергия Гиббса получения водорода методом взаимодействия метана и водяного пара СН4 + 2Н2О (г) = СО2 + 4Н2 рассчитывается по уравнению: Полученное значение DrG° является критерием самопроизвольного протекания реакции (DrG° Энергия Гиббса служит критерием самопроизвольного протекания химической реакции в изобарно-изотермических процессах: — если энергия Гиббса уменьшается, т. е DrG° 0, то реакция не может протекать самопроизвольно; — если DrG° = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т. е. обратима, в системе устанавливается равновесие. Направление химических реакций зависит oi их характера. Для экзотермических реакций (DrH° 0 > 0). В данных реакциях обе движущие силы (DrH°) и (TDrS 0 ) направлены в сторону протекания прямого процесса и DrG° 0 = S 0 CaCO3 — S 0 CaO — S°C02 = -160,6 Дж/К. Воспользуемся уравнением (2.17): Ответ: для стандартного состояния (р = 100 кПа и Т = 298 К) данная реакция возможна. При высоких температурах, когда |DrH°| 0 |, энергия Гиббса реакции станет положительной и реакция становится невозможной в прямом направлении. Температура, при которой DrG° = 0, является температурой установления равновесия в системе или температурой начала реакции. Она позволяет судить о начале развития реакции в нужном направлении: Термодинамические функции состояния зависят от температуры, следовательно, направление протекания химической реакции также зависит от температуры. Влияние температуры на направление химических реакций приведено в табл. 2.1. Энергия Гиббса зависит от характера реакции (значений DrH° и DrS 0 ), а для многих реакций и от температуры. Зная величины DrS 0 и DrH°, можно рассчитать DrG° и соответственно предсказать возможность или невозможность самопроизвольного протекания реакции, а также влияние температуры на направление процесса, и определить температуру начала реакции. http://zadachi-po-khimii.ru/obshaya-himiya/energiya-gibbsa-energiya-gelmgolca-napravlenie-processa.html http://studizba.com/lectures/107-himija/1429-obschaja-himija/26358-23-jenergija-gibbsa-jenergija-gelmgolca-i-napravlennost-himicheskih-reakcij.htmlВсегда ˂0 Реакция самопроизвольна при любых температурах, обратная реакция всегда несамопроизвольна >0 ˂0 Всегда >0 Реакция несамопроизвольна при любых температурах, обратная реакция самопроизвольна ˂0 ˂0 При низких температурах ˂0, при высоких температурах >0 Реакция самопроизвольна при низких температурах, обратная реакция становится самопроизвольной при высоких температурах >0 >0 При низких температурах >0, при высоких температурах ˂0 Реакция несамопроизвольна при низких температурах, но при высоких температурах становится самопроизвольной Энергия Гиббса, энергия Гельмгольца и направленность химических реакций
