Аммиак: получение и свойства
Аммиак
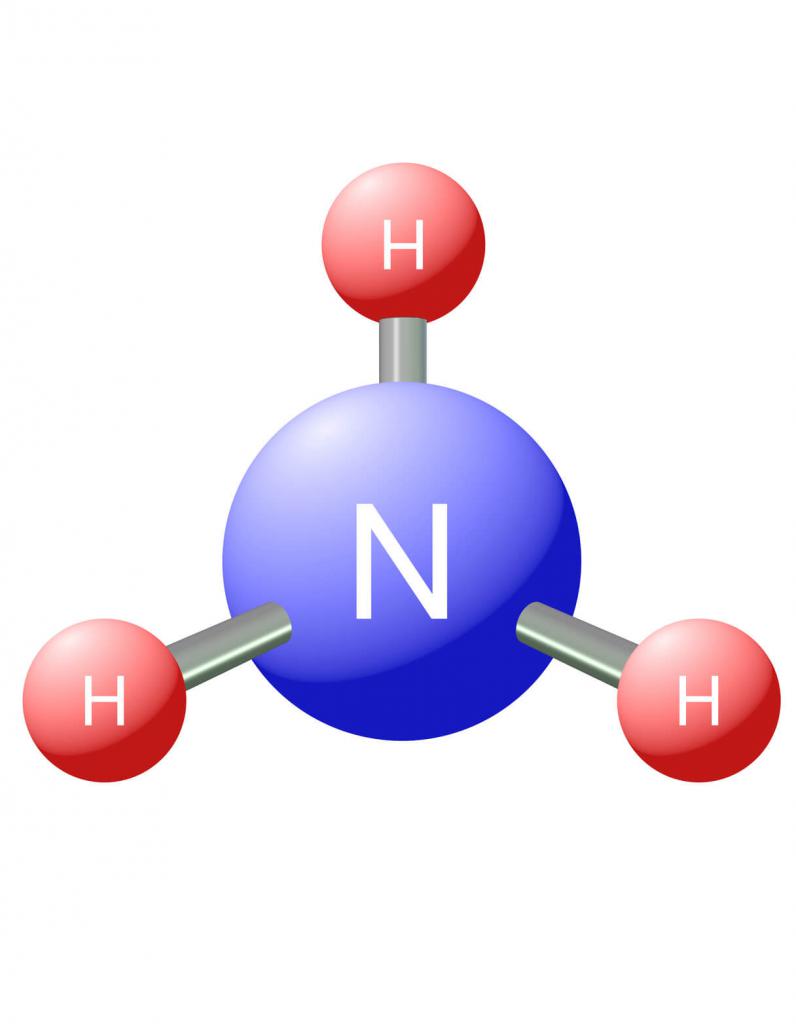
Строение молекулы и физические свойства
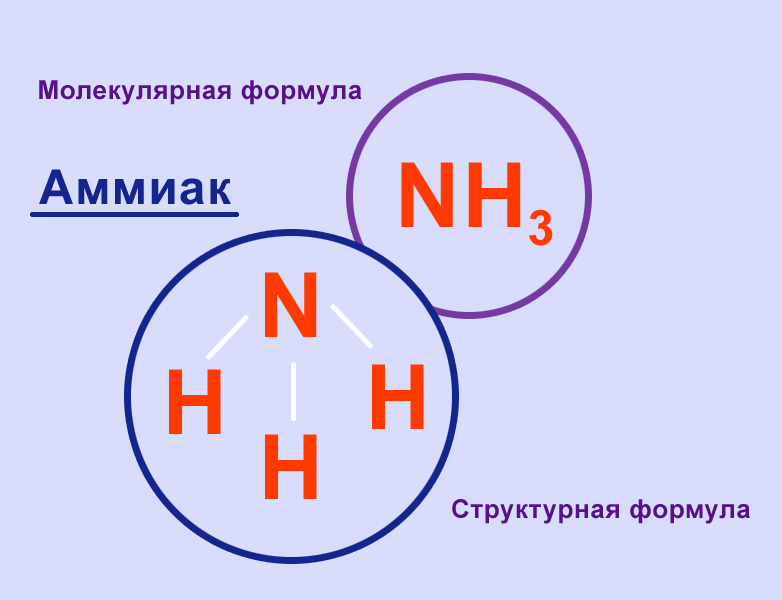
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Нашатырный спирт и аммиак: в чем разница, это одно и то же? Как развести аммиак, чтобы получить нашатырный спирт: пропорции
В данной статье мы поговорим, чем отличается нашатырный спирт от аммиака, а также узнаем, где эти вещества используются.
Нередко средства из аптеки используются в бытовых целях. К примеру, взять нашатырный спирт. Его сфера использования выходит далеко за пределы медицины. Это отличное средство для использования в быту, и даже для подкормки растений в саду. Многие считают, что это вещество то же самое, что и аммиак. Но так ли это? Давайте узнаем.
Что такое аммиак, нашатырь и нашатырный спирт: название, формула, состав
Раствор нашатырного спирта имеет формулу NH4OH. Он жидкий и прозрачный. Его отличительной чертой является сильный резкий запах.

В больших количествах средство не используется, потому что это опасно. Зато небольшая доза способна воздействовать возбуждающее или раздражающе. Основная сфера использования спирта — медицина.
Он позволяет привести в чувство человека, если он упал в обморок. А еще он применяется хирургами. С его помощью они обрабатывают руки перед операцией. Хорошо средство показывает себя и в косметологических целях.
Состоит нашатырный спирт из раствора аммиака 10%, но только не стоит думать, что это одно и то же. Аммиак — это другое вещество и, прежде всего, это газ.
Он становится жидким при температуре в -33 градуса. Но только делается это не с помощью воды, а несколько иным путем. Если просто добавить воды в аммиак, то никакого эффекта от этого не будет.
Способы получения веществ разные. Тем более, что одно получается из другого.
Чем отличается аммиак от нашатырного спирта, нашатыря: отличия
Раствор нашатырного спирта, как мы уже сказали, получается из аммиака. Его хоть и создавали с целью использования в медицине, но в быту он также находит широкое применение. Почему важно это знать?
Прежде всего, аммиак нередко продают в концентрированном виде. Из него делают водный раствор от 25% и выше. В быту категорически запрещено использовать такое средство, потому что над поверхностью раствора всегда содержится скопление газа, который почти в два раза легче воздуха.
При нагревании гидрат аммония распадается. Это может привести к тому, что при открытии емкости с веществом наружу может вырваться «газовая подушка». Поэтому даже при обмороке человеку нельзя сразу давать нюхать средство из бутылочки. Лучше смочите салфетку. Если не придерживаться этой рекомендации, то вместо усиления дыхания может случиться его остановка.
Более того, концентрированный аммиак очень едкий. Он может повредить не только слизистые оболочки, но и кожу. Через последнюю и даже бытовые резиновые перчатки раствор может просачиваться и травить организм.
Даже если разбавить вещество спиртом самостоятельно, могут возникать негативные последствия. В концентрированных растворах содержится много опасных примесей для здоровья человека.
Последний аргумент — различие формул обоих веществ. Аммиак имеет формулу NH3, а нашатырный спирт — NH4OH.
Как развести аммиак, чтобы получить нашатырный спирт: пропорции, процентное соотношение
Как мы уже сказали, не рекомендуется готовить раствор нашатырного спирта. Все же есть способ это сделать. Обычно такое средство используется в быту, чтобы избавиться от насекомых или устранить неприятные запахи на кухне. Для этого надо 1 часть нашатырного спирта смешать 9 частями воды. В процентном соотношении это выглядит следующим образом — 10% спирта и 90% процентов воды.
Более сложный способ чем-то напоминает приготовление медицинского спирта. Различие только в количестве компонентов.

Готовится вещество из водки. Но только недостаточно просто ее купить и заморозить. Это не даст нужного результата, а потому вам потребуется самогонный аппарат. Конечно, после его использования у вас получится что-то крепче водки, но все же не чистый спирт. Для его получения требуется перегонка водки.
Вам потребуется для этого:
- Кондитерские дрожжи
- Простой пакет
- Стеклянная банка
У вас все должно находиться под рукой. Итак, приготовление будет следующим:
- Вылейте сок или морс, который вы приготовили в стеклянную банку
- Добавьте к нему дрожжи. Рассчитывайте, что на 1,5 литра напитка добавляется 30 г дрожжей
- Хорошо смешайте состав и закройте крышкой
- Закрытую банку поместите на батарею
- Открывайте ее каждый день, чтобы выходил углекислый газ. Если этого не делать, то потом и не удивляйтесь, что ваша банка взорвалась
- Так делайте несколько дней, пока не выделится спирт. Чем дольше вы будете хранить банку, тем больше выделится спирта
- Через какое-то время смесь застынет и спирт можно будет слить
Чтобы убедиться, что у вас точно получился нашатырь, налейте немного жидкости в столовую ложку и снизу попробуйте нагреть. Она должна вспыхнуть.
Нашатырный спирт, аммиак, нашатырь: применение в медицине и быту
Очень много вопросов вызывает момент, как использовать раствор нашатыря, а точнее — для какой цели это можно делать?
Итак, существует несколько сфер, где применяется нашатырь.
С помощью аммиачной воды эффективно выводятся пятна с любых поверхностей. Например, вы хотите убрать пятно на любимой футболке. Тогда в стакан воды добавьте 2 ложки нашатыря и залейте пятно на пару минут. После этого можно прополоскать вещь. Если вы боитесь, что останется запах, то зря, потому что запаха после нашатыря не остается.
Кстати, этого средства очень боятся тараканы. Когда моете пол, то в ведро воды добавьте немного нашатыря. На 1 литр добавляется 1 чайная ложка. Резкий запах тараканам очень не нравится и они уходят. Процедуру рекомендуется делать каждую неделю даже для профилактики. Не нравится нашатырь и комарам с мошками. Достаточно вокруг себя набрызгать раствор и насекомые даже не будут приближаться.
Очистить сантехнику, серебряные или золотые изделия тоже помогает это средства. Нужно смешать воду, зубной порошок и нашатырь. Соотношение будет 5:2:1. После этого возьмите мягкую марлю и смочите раствором. Протрите нужный предмет и хорошо промойте его водой.
- Для комнатных растений

Комнатным растениям важен кислород и питание. Нашатырь прекрасно справляется с обеими задачами, а еще он защищает цветы от вредителей. Разведите большую ложку средства в трех литрах воды и у вас получится отличная подкормка. Просто поливайте такой водой цветы и они будут у вас активно расти.
Если у вас есть проблемы с тлей, то вынести цветы на балкон и опрыскайте. Раствор готовится также из трех литров воды, но в него добавляется уже три столовых ложки нашатыря и две капли шампуня.
Для дачи нашатырь тоже незаменим. С ним проводится профилактическая обработка деревьев, кустарников и ягод. Подкормка готовится из 4 литров воды и 50 мл раствора. Поливать растения таким способом можно до конца июня с самой посадки. Такой раствор отпугивает вредителей.
Аммиак отлично справляется с прыщами на жирной коже. Его применяют для умывания. Раствор получается очень простой — половина чайной ложки на стакан теплой воды. Более того, можно отдельно протирать проблемные места ватным тампоном.
Как известно, нашатырь используется для приведения человека в чувство после обморока. При этом, он хорошо удаляет прыщи, помогает при отравлениях, и от укусов насекомых. Даже от боли в суставах и похмелья этот спирт может помочь. Конечно, его сфера использования значительно шире и есть немало других заболеваний, которые помогает лечить это средство.
В косметологии раствор тоже широко используется. Если его смешать с глицерином, то получится идеальное средство от сухой кожи ног и рук. Лосьон устраняет трещины и размягчает кожу. Еще неплохо нашатырь воздействует на волосы, если использовать его в качестве ополаскивателя. Для этого в стакане теплой воды растворите чайную ложку спирта.
Чем отличается аммиачная селитра от нашатырного спирта?
Многие интересуются, чем отличается раствор нашатырного спирта от аммиачной селитры? На самом деле последнее вещество создано специально для сельского хозяйства. Если не вдаваться в подробности, то это специальное удобрение.
Оно не просто выполняет роль нашатырного спирта, но еще и укрепляет здоровье растений. То есть, защищает их от болезней. Работает вещество даже на мерзлой земле. Ему достаточно попасть в грунт. Идеально подходит удобрение для щелочной почвы.
Видео: Нашатырный спирт — лучший помощник на даче. Супер удобрение
Аммиак — это нашатырный спирт. Формула, свойства и применение аммиака
Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака
Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
Именование «нашатырь» он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование «аммиак», которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза. Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Состав молекулы
Молекула аммиака (NH3) имеет форму тетраэдра с атомом азота в вершине. В ней находятся четыре электронных облака, которые перекрываются вдоль линии связи, следовательно, в молекуле содержатся исключительно сигма-связи. По сравнению с водородом азот имеет большую электроотрицательность, поэтому общие электронные пары в молекуле смещены в его сторону. И так как в аммиаке везде одинарные связи, то тип гибридизации – sp 3 , а угол между электронными облаками равен 109 градусам.
Способы получения
В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
4. Или нагреванием хлорида аммония с концентрированной щелочью:
Применение
Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака
Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
- С водой образуется неустойчивый гидрат аммиака.
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
С оксидами металлов.
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния
Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Отравление аммиаком
Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Последствия отравления
После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
http://ladyle.ru/nashatyrnyj-spirt-i-ammiak-v-chem-raznica-eto-odno-i-to-zhe-kak-razvesti-ammiak-chtoby-poluchit-nashatyrnyj-spirt-proporcii
http://www.syl.ru/article/430916/ammiak—eto-nashatyirnyiy-spirt-formula-svoystva-i-primenenie-ammiaka