Калий: способы получения и химические свойства
Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Калий и натрий
- Краткая характеристика и нахождение в природе.
- История открытия.
- Физические свойства.
- Химические свойства.
- Едкие щелочи. Соли металлов.
- Способы получения и область применения.
- Краткая характеристика и нахождение в природе.
Натрий и калий относятся к числу довольно распространенных элементов.
Содержание натрия в земной коре составляет 2,64%, калия – 2,6%.
В свободном виде калий и натрий в природе не встречаются. Эти щелочные металлы входят в состав различных соединений. Одним из таких соединений является – хлорид натрия NaCl (образует залежи каменной соли — Донбасс, Соликамск, Соль-Илецк и др).
Также хлорид натрия содержится в морской воде и соляных источниках.
Калийные соли также присутствуют в морской воде, но в значительно меньших количествах. Обычно калийные соли содержат верхние слои залежей. Самые большие в мире запасы калийных солей находятся на Урале в районе Соликамска. В Белоруссии (г.Солигорск) открыты крупные залежи калийных солей
Мы не случайно рассматриваем натрий и калий вместе, сходные своими физическими свойствами, они и открыты были одновременно.
В 1807 г. Дэви, путем электролиза слегка увлажненных твердых щелочей, были получены свободные металлы — калий и натрий. В то время они получили названия — потассий (Potassium) и содий (Sodium).
В следующем году Гильберт, издатель известных «Анналов физики»,
предложил именовать новые металлы калием и натронием (Natronium).
Позднее Берцелиус сократил последнее название до «натрий» (Natrium).
Вообще, название «натрий» (англ. и франц. Sodium, нем. Natrium) происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян и соответствует древнееврейскому нетер (neter).
В древнем Египте натроном, или нитроном называли щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации
трупов. В конце XVIII в. Клапрот ввел для минеральной щелочи
название натрон (Natron), а для растительной — кали (Kali).
Известно, что в начале XIX в. в России натрий называли содием.
Что касается слова калий, то оно происходит от арабского термина
алкали (щелочные вещества, именуемые в средние века “щелочные соли”). В то время их еще не отличали друг от друга и называли именами, имевшими сходное значение: натрон, боракс, варек т. д. Слово кали (qila) впервые встречается в 850 г. у арабских писателей, затем начинает употребляться слово Qali (al-Qali), которое обозначало продукт, получаемый из золы некоторых
растений. В России, в первой четверти XIX в., калий назывался потассий, поташ, а также поташий. В 1828 г. в химической литературе наряду с названием поташ уже встречается название кали (едкое кали, кали соляный и др.).
Название калий стало общепринятым во всем мире после выхода в свет учебника Гесса.
Калий и натрий – серебристо-белые металлы, с плотностью
K = 0,86 г/см3, Na = 0,97г/см3,
Эти металлы очень мягкие, режутся ножом.
Обладают всеми свойствами, присущими веществам с металлической связью, а именно: металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Это обусловлено тем, что в атомах щелочных металлов один внешний электрон приходится на 4 и более свободные орбитали, а энергия ионизации атомов низкая, в следствии чего между атомами металлов возникает металлическая связь.
В природе натрий состоит из одного изотопа
калий – из двух стабильных изотопов
При химическом взаимодействии, атомы калия и натрия легко отдают валентные электроны, переходя в положительно заряженные ионы: K+ и Na+. Оба металла являются сильными восстановителями.
Быстро окисляются на открытом воздухе, поэтому необходимо хранить калий и натрий под слоем керосина.
Реакция с водой — бурная. Эти металлы легко взаимодействуют со многими неметаллами –серой, фосфором, галогенами и др.
Образуют гидриды NaH, KH, взаимодействуя с водородом, при нагревании. Эти гидриды легко разлагаются водой с образованием
соответствующей щелочи и водорода:
NaH + H2O = NaOH + H2
При сгорании натрия в избытке кислорода образуется пероксид натрия Na2O2, который в свою очередь взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
На этой реакции основано применение пероксида натрия для получения кислорода на
подводных лодках и для регенерации воздуха в закрытых помещениях.
Едкие щелочи. Соли металлов.
Едкими щелочами называются хорошо растворимые в воде гидроксиды. Важнейшие из них NaOH и KOH.
Гидроксид натрия и гидроксид калия – белые, непрозрачные, твердые
кристаллические вещества. В воде хорошо растворяются с выделением большого количества теплоты. В водных растворах практически нацело диссоциированы и являются сильными щелочами. Проявляют все свойства оснований.
Твердые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
или в иной форме:
2OH- + CO2 = CO + H2O
В твердом состоянии на воздухе NaOH и KOH поглощают влагу, благодаря чему используются как осушители газов.
В промышленности гидроксид натрия и гидроксид калия получают электролизом концентрированных растворов соответственно NaCl и KCl. При этом одновременно получаются хлор и водород. Катодом служит железная сетка, анодом – графит.
Схему электролиза (на примере KCl) следует представлять так, KCl полностью диссоциирует на ионы K+ и Cl-. При прохождении электрического тока к катоду подходят ионы K+, к аноду – хлорид-ионы Cl-. Калий в ряду стандартных электродных потенциалов расположен до алюминия, и его ионы восстанавливаются
(присоединяют электроны) гораздо труднее, чем молекулы воды. Ионов же водорода H+ в растворе очень мало. Поэтому на катоде разряжаются молекулы воды с выделением молекулярного водорода:
2H2O + 2e- = H2 + 2OH-
Хлорид-ионы в концентрированном растворе легче отдают электроны (окисляются), чем молекулы воды, поэтому на аноде разряжаются хлорид-ионы:
Общее уравнение электролиза раствора в ионной форме:
2H2O + 2e- = H2 + 2OH- 1
2Cl- + 2H2O электролиз H2 + 2OH- + Cl2
2KCl + 2H2O электролиз H2 + 2KOH + Cl2
Аналогично протекает электролиз раствора NaCl. Раствор, содержащий NaOH и NaCl, подвергается упариванию, в результате чего выпадает в осадок хлорид натрия (он имеет намного меньшую растворимость и она мало изменяется с температурой), который отделяют и используют для дальнейшего электролиза. Гидроксид натрия получают в очень больших количествах. Он является одним из важнейших продуктов основной химической промышленности. Применяют его для очистки нефтяных продуктов – бензина и керосина, для производства мыла, искусственного шелка, бумаги, в текстильной, кожевенной, химической промышленности, а также в быту (каустик,каустическая сода).
Более дорогой продукт – гидроксид калия – применяется реже, чем NaOH.
Соли калия и натрия.
Практически все соли калия и натрия растворимы в воде.
Натрий способен образовывать соли со всеми кислотами.
Наиболее распространенными и используемыми в быту и промышленности являются – хлорид натрия NaCl (поваренная соль), сода и сульфат натрия Na2SO4.
Рассмотрим каждую из них в одельности.
Хлорид натрия NaCl – используется для консервирования пищевых продуктов, в качестве приправы при приготовлении пищи, является сырьем в промышленности при получения гидроксида натрия, хлора, соляной кислоты, соды и др.
Сульфат натрия Na2SO4 – используется в промышленности для приготовления глауберовой соли, путем кристаллизации десятиводного гидрата Na2SO4 * 10H2O.
Глауберова соль применяется в медицине как слабительное.
Соли натрия и калия (ионы натрия и калия), применяются при качественном обнаружении натрия и калия в соединениях.
Соли натрия окрашивают пламя горелки в желтый цвет.
Соли калия окрашивают пламя горелки в фиолетовый цвет.
Это очень чувствительный метод. Единственный его минус то, что в присутствии даже ничтожных количеств натрия в соединениях фиолетовый цвет маскируется желтым. В этом случае используют синее стекло, поглощающее желтые лучи.
Калийные соли используют главным образом как калийные удобрения.
- Получение и область применения.
Натрий получают в процессе электролиза расплавленного хлорида натрия или гидроксида натрия.
При электролизе расплава гидроксида натрия NaOH на катоде выделяется натрий:
а на аноде – вода и кислород:
4OH- — 4e- = 2H2O + O2
При электролизе расплава хлорида натрия NaCl на катоде выделяется натрий:
А на аноде – хлор:
Предпочтительнее, с экономической точки зрения, вследствие дороговизны гидроксида натрия,использовать в качестве основного метода электролиз расплава NaCl.
Также как и натрий, калий можно получить в процессе электролиза хлорида калия KCl и гидроксида калия KOH.
Но этот способ не получил широкого распространения, т.к. в процессе электролиза возник ряд технических трудностей, в том числе, трудность обеспечения техники безопасности.
На сегодняшний день получение калия в промышленности основано на следующих реакциях:
1. KCl + Na Ы NaCl + K
При получении калия этим способом, через расплавленный хлорид калия пропускают пары натрия при 8000С, а выделяющиеся пары калия конденсируют.
2. KOH + Na Ы NaOH + K
Здесь взаимодействие между расплавленным гидроксидом калия и жидким натрием осуществляется противотоком при температуре 4400С в реакционной колонне из никеля.
Также этими способами можно получать сплав калия с натрием. Этот сплав применяется:
в атомных реакторах, как жидкий металлический теплоноситель.
в качестве восстановителя при производстве титана.
Широко используют калий и его соединения в различных отраслях хозяйства:
- при получении некоторых красителей,
- при гидролизе крахмала,
- при производстве пороха,
- при отбелке тканей.
С помощью пероксидов натрия и калия проводится регенерация воздуха в космических кораблях и подводных лодках.
Поташ в больших количествах идет на производство стекла. Используя едкий калий производят самое лучшее — жидкое туалетное мыло.
1. “Пособие по химии для поступающих в вузы”. Г.П.Хомченко. 1976 г.
2. “Основы общей химии”. Ю.Д.Третьяков, Ю.Г.Метлин. Москва “Просвещение” 1980 г.
Ошибка в тексте? Выдели её мышкой и нажми
Остались рефераты, курсовые, презентации? Поделись с нами — загрузи их здесь!
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.
Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 1 :
- Li — 2s 1
- Na — 3s 1
- K — 4s 1
- Rb — 5s 1
- Cs — 6s 1
- Fr — 7s 1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит
Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
K + O2 → KO2 (супероксид калия)
Реакции с неметаллами
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Реакция с водой
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «. в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.
Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)
NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://studyport.ru/referaty/estestvennye-nauki/3101-kalij-i-natrij
http://studarium.ru/article/163

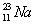 В природе натрий состоит из одного изотопа
В природе натрий состоит из одного изотопа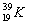 калий – из двух стабильных изотопов
калий – из двух стабильных изотопов





