Найти уравнение процесса при котором молярная теплоемкость
2018-04-16 
Найти для идеального газа уравнение процесса (в переменных $T, V$), при котором молярная теплоемкость газа изменяется по закону:
а) $C = C_
Здесь $\alpha , \beta$ и $a$ — постоянные.
Теплоемкость определяется $C = C_
(a) Учитывая $C = C_
Итак, $C_
Интегрируя обе стороны, получаем $\frac< \alpha >
(b) $C = C_
а также $C = C_
Интегрируя обе стороны, получаем $\frac
(с) $C = C_
Так, $C_
или, $a \frac
или, $\frac
 Задачи с решениями
Задачи с решениями 

Определите молярную теплоемкость углекислого газа (CO2) в процессе, в котором давление изменяется пропорционально объему , где .
Решение
Первый способ.
Углекислый газ состоит из трехатомных молекул. Следовательно, его молярная теплоемкость в процессе с постоянным объемом . Для нахождения молярной теплоемкости газа в процессе , запишем первый закон термодинамики для одного моля газа для малых изменений объема.
Искомая теплоемкость равна
Чтобы найти выражение 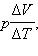
Но из уравнения процесса вытекает:
Искомая теплоемкость равна
Задача может быть решена и другим, графическим способом. Изобразим процесс на плоскости для газа (рис. 3.10.1).
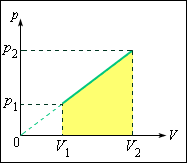 |
| Рисунок 3.10.1. Пусть на некотором участке процесса объем изменяется от до . Запишем первый закон термодинамики Работу газа рассчитаем с помощью графика Из уравнения состояния идеального газа следует, что эта работа равна Изохорная теплоемкость идеального газаВ термодинамике при изучении переходов из начального в конечное состояние некоторой системы важно знать тепловой эффект процесса. С этим эффектом тесно связано понятие теплоемкости. В данной статье рассмотрим вопрос, что понимают под изохорной теплоемкостью газа. Идеальный газИдеальным называется такой газ, частицы которого считаются материальными точками, то есть не имеют размеров, но обладают массой, и у которого вся внутренняя энергия состоит исключительно из кинетической энергии движения молекул и атомов. Любой реальный газ в идеале никогда не будет удовлетворять описанной модели, поскольку его частицы все же имеют некоторые линейные размеры и взаимодействуют между собой с помощью слабых ван-дер-ваальсовых связей или химических связей другого типа. Однако при низких давлениях и высоких температурах расстояния между молекулами велики, а их кинетическая энергия превышает потенциальную в десятки раз. Все это позволяет применять с высокой степенью точности идеальную модель для реальных газов. Внутренняя энергия газаВнутренняя энергия любой системы — это физическая характеристика, которая равна сумме потенциальной и кинетической энергии. Поскольку в идеальных газах можно пренебречь потенциальной энергией, то для них можно записать равенство: Где Ek — энергия кинетическая системы. Используя молекулярно-кинетическую теорию и применяя универсальное уравнение состояния Клапейрона-Менделеева, несложно получить выражение для U. Оно записано ниже: Здесь T, R и n — абсолютная температура, газовая постоянная и количество вещества соответственно. Величина z — это целое число, показывающее количество степеней свободы, которыми обладает молекула газа. Изобарная и изохорная теплоемкостьВ физике теплоемкостью называется количество теплоты, которое необходимо предоставить изучаемой системе, чтобы нагреть ее на один кельвин. Справедливо также и обратное определение, то есть теплоемкость — это количество теплоты, которое система выделяет при охлаждении на один кельвин. Проще всего для системы определить изохорную теплоемкость. Под ней понимают теплоемкость при постоянном объеме. Поскольку система в таких условиях работу не совершает, то вся энергия расходуется на повышение внутренних энергетических запасов. Обозначим изохорную теплоемкость символом CV, тогда можно записать: То есть изменение внутренней энергии системы прямо пропорционально изменению ее температуры. Если сравнить это выражение, с записанным в предыдущем пункте равенством, то приходим к формуле для CV в идеальном газе: Данной величиной на практике неудобно пользоваться, поскольку она зависит от количества вещества в системе. Поэтому было введено понятие удельной изохорной теплоемкости, то есть величины, которую рассчитывают либо на 1 моль газа, либо на 1 кг. Обозначим первую величину символом CV n , вторую — символом CV m . Для них можно записать такие формулы: Здесь M — молярная масса. Изобарной называется теплоемкость при поддержании постоянного давления в системе. Примером такого процесса является расширение газа в цилиндре под поршнем при его нагревании. В отличие от изохорного, во время изобарного процесса подводимое к системе тепло расходуется на повышение внутренней энергии и на выполнение механической работы, то есть: Энтальпия изобарного процесса представляет собой произведение изобарной теплоемкости на изменение температуры в системе, то есть: Если рассмотреть расширение при постоянном давлении 1 моль газа, то первое начало термодинамики запишется в виде: Последнее слагаемое получено из уравнения Клапейрона-Менделеева. Из этого равенства следует связь между изобарной и изохорной теплоемкостями: Для идеального газа удельная молярная теплоемкость при постоянном давлении всегда больше соответствующей изохорной характеристики на величину R=8,314 Дж/(моль*К). Степени свободы молекул и теплоемкостьВыпишем еще раз формулу для удельной молярной изохорной теплоемкости: В случае газа одноатомного величина z = 3, поскольку атомы в пространстве могут перемещаться лишь в трех независимых направлениях. Если же речь идет о газе, состоящем из двухатомных молекул, например, кислород O2 или водород H2, то, помимо поступательного движения, эти молекулы могут еще вращаться вокруг двух взаимно перпендикулярных осей, то есть z будет равно 5. В случае более сложных молекул для определения CV n следует использовать z=6. источники: http://physics.ru/courses/op25part1/content/chapter3/section/paragraph10/tsol1.html http://fb.ru/article/460319/izohornaya-teploemkost-idealnogo-gaza |

 Задачи с решениями
Задачи с решениями 

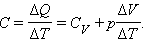
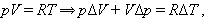
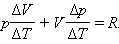
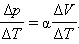
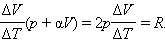
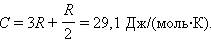
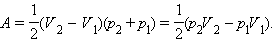
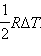 Отсюда следует:
Отсюда следует: