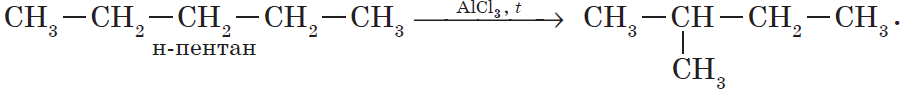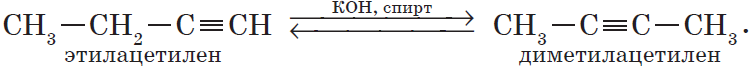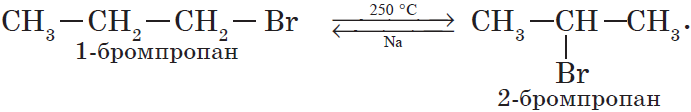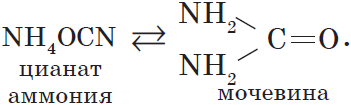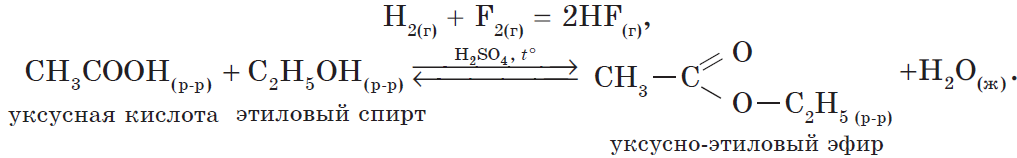Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de816850e6e03e6 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Классификация химических реакций в неорганической и органической химии
Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
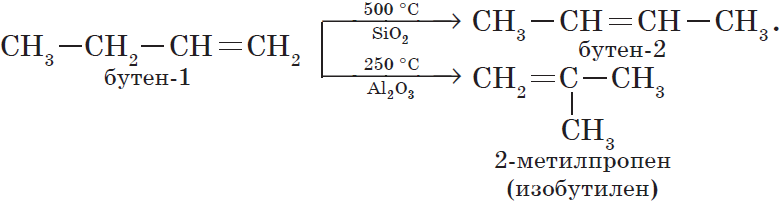
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2<⇄>↖
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO<→>↖
2) разложение нитрата калия:
$2KNO_3<→>↖
3) разложение перманганата калия:
$2KMnO_4<→>↖
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
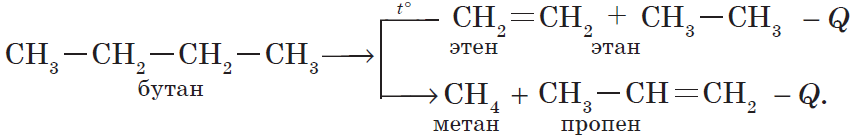
3) реакция крекинга (расщепления) пропана:
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
или в ионном виде:
2) реакция между щелочью и солью, идущая с образованием газа:
или в ионном виде:
3) реакция между щелочью и солью, идущая с образованием осадка:
или в ионном виде:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
- многие реакции разложения:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Каталитическая реакция — это что такое? Основные принципы и типы
Большую часть процессов, лежащих в основе химической технологии, составляют каталитические реакции. Это связано с тем, что при введении катализатора скорость взаимодействия веществ существенно увеличивается. При этом производителям удается сократить расходы или же получить большее количество продуктов реакции за тот же период времени. Именно поэтому изучению катализа уделяется много внимания при подготовке технологов. Однако это явление играет важную роль и в природе. Так, особые вещества регулируют протекание биохимических реакций в живых организмах, влияя тем самым на обмен веществ.
Понятие катализа
Суть этого химического явления заключается в регулировании скорости превращения веществ с использованием особых реагентов, способных замедлять или ускорять этот процесс. При этом говорят о положительном или отрицательном катализе. Существует также явление автокатализа, когда на скорость реакции влияет один из промежуточных продуктов химической реакции. Каталитические процессы разнообразны, отличаются они механизмами, агрегатным состоянием соединений и направлением.
Вещества, которые замедляют химические взаимодействия, называют ингибиторами, а ускоряющие каталитические реакции — катализаторами. И те, и другие изменяют скорость реакции путем многократного промежуточного взаимодействия с одним или несколькими ее участниками. При этом они не входят в состав продуктов и восстанавливаются после окончания цикла превращения веществ. Поэтому участие катализатора не отражают в уравнении реакции стехиометрически, а лишь указывают как условие взаимодействия веществ.
Виды каталитических реакций
По агрегатному состоянию веществ, принимающих участие в химической реакции, различают:
- гомогенные реакции — реагирующие вещества, продукты и катализатор находятся в одном агрегатном состоянии (фазе), при этом молекулы веществ равномерно распределены по всему объему;
- межфазные каталитические реакции — происходят на границе раздела несмешивающихся жидкостей, а роль катализатора сводится к переносу реагентов через нее;
- гетерогенные каталитические реакции — в них катализатор имеет отличное от реагентов агрегатное состояние, а сама она осуществляется на поверхности раздела фаз;
- гетерогенно-гомогенные реакции — инициируются на поверхности раздела с катализатором, а продолжаются в реакционном объеме;
- микрогетерогенные реакции — мелкие частички твердого катализатора образуют мицеллы по всему объему жидкой фазы.
Существует также окислительно-восстановительный катализ, сопровождающийся изменением степени окисления катализатора при взаимодействии с реагентами. Такие превращения называют каталитическими реакциями окисления и восстановления. Наиболее распространено в химическом производстве окисление диоксида серы до триоксида при получении серной кислоты.
Виды катализаторов
По агрегатному состоянию катализаторы бывают жидкие (H2SO4, Н3РО4), твердые (Pt, V2О5, Al2О3) и газообразные (BF3).
По типу вещества катализаторы классифицируют на:
- металлы — могут быть чистыми, сплавами, цельными или нанесенными на пористую основу (Fe, Pt, Ni, Cu);
- соединения металлов типа МmЭn — наиболее распространены оксиды MgO, Al2О3, МоО3 и др.;
- кислоты и основания — используются для кислотно-основных каталитических реакций, это могут быть кислоты Льюиса, Бренстеда и др.;
- комплексы металлов — в эту группу включают также соли переходных металлов, например PdCl2, Ni(СО)4;
- ферменты (они же энзимы) — биокатализаторы, ускоряющие реакции, идущие в живых организмах.
По специфике электронного строения различают d-катализаторы, имеющие d-электроны и d-орбитали, а также s,р-катализаторы, центром которых является элемент с валентными s и р-электронами.
Свойства катализаторов
Для эффективного использования к ним применяется довольно обширный список требований, изменяющийся для конкретного процесса. Но наиболее значимы следующие два свойства катализаторов:
- Специфичность, заключается в способности катализаторов влиять только на одну реакцию или ряд однотипных превращений и не воздействовать на скорость других. Так, платина чаще всего используется в органических реакциях гидрирования.
- Селективность, характеризуется способностью ускорять одну из нескольких возможных параллельно протекающих реакций, тем самым увеличивать выход наиболее важного продукта.
Скорость каталитической реакции
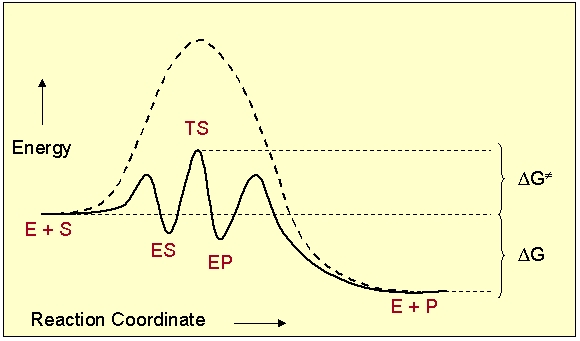
Причиной ускорения взаимодействия веществ является образование активного комплекса с катализатором, приводящее к снижению энергии активации.
Согласно основному постулату химической кинетики, скорость любой химической реакции прямо пропорциональна произведению концентраций исходных веществ, которые взяты в степенях, соответствующих их стехиометрических коэффициентам:
где k — константа скорости химической реакции, численно равная скорости этой же реакции, при условии, что концентрации исходных соединений равны 1 моль/л.
По уравнению Аррениуса k зависит от энергии активации:
Указанные закономерности справедливы и для каталитических реакций. Это подтверждает и уравнение, для отношения констант скоростей:
где переменные с индексом К относятся к каталитическим реакциям.
Стадии каталитических реакций
Для гомогенных каталитических реакций достаточно двух основных стадий:
- Образование активированного комплекса: А + К ―> АК.
- Взаимодействие активированного комплекса с другими исходными веществами: АК + В ―> С + К.
В общем виде записывают уравнение вида А + В ―> С.
Механизм гетерогенных каталитических реакций сложен. Выделяют следующие шесть стадий:
- Подведение к поверхности катализатора исходных соединений.
- Адсорбция исходных реагентов поверхностью катализатора и образование промежуточного комплекса: А + В + К ―> АВК.
- Активация образовавшегося комплекса: ΑВК ―> ΑВК * .
- Распад комплексного соединения, при этом образовавшиеся продукты адсорбированы катализатором: ΑВК * ―> CDK.
- Десорбция полученных продуктов поверхностью катализатора: CDK ―> С + D + К.
- Отвод продуктов от катализатора.
Примеры каталитических реакций
Катализаторы используют не только в химической промышленности. Любой человек в своей повседневной жизни сталкивается с различными каталитическими реакциями. Это, например, использование перекиси водорода при обработке ран. Пероксид водорода при взаимодействии с кровью начинает разлагаться под влиянием фермента каталазы:
В современных автомобилях система выхлопа снабжена особыми каталитическими камерами, способствующими разложению вредных газообразных веществ. Например, платина или родий помогают снижать уровень загрязнения окружающей среды оксидами азота, которые разрушаются с образованием безвредных О2 и N2.
В некоторых зубных пастах содержатся ферменты, инициирующие разложение зубного налета и остатков пищи.
http://examer.ru/ege_po_himii/teoriya/klassifikaciya_ximicheskix_reakcij_v
http://fb.ru/article/374751/kataliticheskaya-reaktsiya—eto-chto-takoe-osnovnyie-printsipyi-i-tipyi