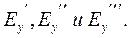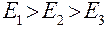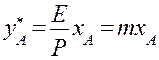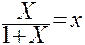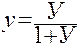Тепловой баланс абсорбера. Неизотермическая абсорбция
| B |
| A |
| y0 |
| y |
| y1 |
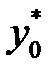 |
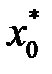 |
| x0 |
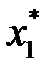 |
| x |
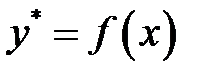 |
| tн |
| tк |
При физической абсорбции газа выделяется тепло. Для предотвращения резкого снижения растворимости газа при повышении температуры абсорбента последний приходится охлаждать с помощью теплообменников. При составлении теплового баланса нагреванием газовой фазы можно пренебречь. Пусть q – дифференциальная теплота растворения газа, кДж/кмоль. Уравнение теплового баланса для верхней части аппарата (выше произвольного сечения):
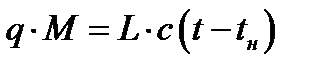
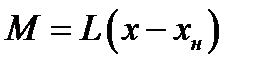
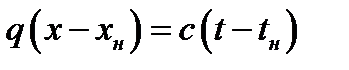

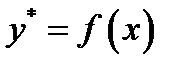
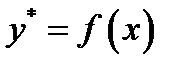
Кривая АВ – для неизотермической абсорбции (без отвода тепла), т.е. адиабата. Абсорбция практически изотермична при малом q. Если q большое, для изотермичности необходим эффективный теплоотвод.
Дата добавления: 2015-01-19 ; просмотров: 1811 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
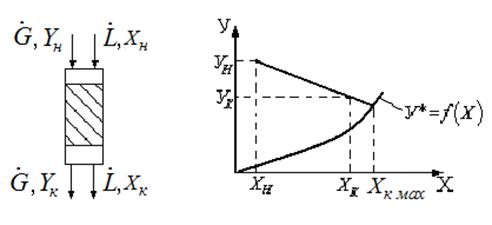
Материальный и тепловой баланс абсорбции
При составлении материального баланса концентрации компонента в газовой и жидкой фазах выражают в относительных концентрациях: Y, кг/кг, инертного газа, Х, кг/кг, растворителя:


где Mк, Muн,,Мр – молекулярные массы растворяемого компонента, инертного газа и растворителя.
Уравнение материального баланса имеет следующий вид:

где М – количество поглощаемого компонента в единицу времени; Gин – расход газовой фазы, проходящей через аппарат; Lo – расход абсорбента; Yн, Yк, Хк, Хн– концентрации компонента в газовой и жидкой фазе соответственно.
На практике конечную концентрацию компонента в растворе необходимо максимально увеличивать, т. к. это позволяет снизить расход абсорбента, а конечную концентрацию компонента в газе максимально понижать, увеличивая тем самым полноту извлечения. При этом следует учитывать, что при приближении к максимальной возможной конечной концентрации раствора и максимальному извлечению компонента из газа, т. е. к равновесному состоянию системы, движущая сила процесса стремится к нулю.
Это приводит к уменьшению скорости процесса, увеличению размеров аппарата и неоправданным затратам. Поэтому на практике не допускают равновесных состояний, а конечные концентрации компонента в газовой и жидкой фазах определяют технико-экономическими расчетами.

Особый интерес для оценки энергетических затрат представляет тепловой баланс процесса. Теплота, выделяемая при абсорбции, существенно влияет на температуру процесса, поэтому необходимо учитывать зависимость равновесного состояния от температуры.
Тепловой баланс абсорбера может быть записан уравнением

где tн, tк, θн, θк – температуры жидкости и газа на входе в аппарат и на выходе; сг и сж – удельные теплоемкости жидкости и газа; Qт – тепловые потери и охлаждение абсорбента; Qабс– теплота, выделяющаяся при абсорбции.
При отсутствии отвода теплоты (Qт = 0) и допущении, что все выделившееся в результате абсорбции тепло остается в абсорбере, т. е. при условии tн = tк, нагрев становится максимальным, тогда
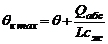

где Ф – теплота растворения газа.
Теплота при абсорбции паров веществ равна сумме теплоты парообразования и теплоты растворения жидкого целевого компонента в поглотителе Фж. Если жидкая фаза – идеальный раствор, то Фж=0. Проводя расчеты, необходимо сравнить предельные значения насыщения поглотителя, достигаемые при температурах θн и θкmax.
Составляя тепловой баланс, допускают, что теплота абсорбции полностью идет на нагрев абсорбента. Учитывая, что теплоемкость газа значительно меньше теплоемкости жидкости, можно пренебречь также изменением температуры газовой фазы, и тепловой баланс абсорбера примет следующий вид:

где Lн, Lк – расход жидкой фазы на входе и выходе из аппарата, кг/с, с учетом количества поглощенного вещества; сни ск – удельная теплоемкость жидкой фазы на входе и выходе из абсорбера, Дж/(кг× о С).
Удельная теплоемкость рассчитывается по правилу аддитивности. При незначительных изменениях концентрации абсорбтива в газовой фазе можно пренебречь изменением массы абсорбента и удельной теплоемкости жидкой фазы и принять: Lн=Lк =L и сн=ск=С.
Qабс рассчитывают по формуле:

где qабс – удельная теплота абсорбции, Дж/кг, жидкой фазы.
Тепловой баланс следует представить так:
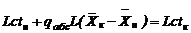

где с – средняя удельная теплоемкость жидкой фазы, Дж/кг, которая определяется как среднее арифметическое величин сн и ск..
При незначительном изменении температуры жидкой фазы (tн=tк) абсорбцию можно считать изотермической. Сильное изменение температуры жидкости вызывает смещение равновесного состояния системы, что следует учитывать при построении равновесной линии. Увеличение температуры жидкой фазы приводит к уменьшению движущей силы процесса. Для сохранения стабильных характеристик процесса в таких случаях необходимо поддерживать постоянную температуру абсорбента путем отвода теплоты, выделяющейся в процессе в специальных охлаждающих устройствах.
Кинетика абсорбции
Процесс абсорбции (рис. 2) характеризуют тремя стадиями:
– подходом молекул абсорбируемого компонента из основной массы газа непосредственно к поверхности раздела фаз;
– растворением молекул газа в поверхностном слое жидкости;

Движущая сила первой стадии – разность концентраций абсорбируемого компонента в основной массе газа у и в газе, непосредственно контактирующем с жидкостью 


где 

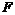
Вторая стадия процесса абсорбции (растворение) идет с высокой скоростью и не влияет на суммарную скорость процесса, лимитируемую наиболее медленной стадией. Принимают, что на поверхности раздела фаз существует состояние равновесия и выполняется равенство

Движущая сила третьей стадии – разность концентраций растворенного газа в поверхностном слое 

где М2 – количество поглощаемого компонента, переносимого в единицу времени с поверхности жидкости в основную ее массу, кг/(м 2 ×с); 
Для установившегося процесса справедливо М1=М2=М. В противном случае (М1 
При равновесии, учитывая уравнения (14) и (15), получим


Сложим левые и правые части этих уравнений и получим уравнение массопередачи

В уравнении (19) у – mх = у – у / = 


В формуле (19) множитель 
Выражение (19) целесообразно представить в следующем виде:
Коэффициент массопередачиКy характеризует скорость процесса. Численно он равен количеству газа, абсорбируемому жидкостью в единицу времени на площади поверхности контакта 1 м 2 при разности концентраций у – у / =1.
Общее сопротивление массопередачи– 
Для газов с малой растворимостью величина m достаточно велика. В этом случае в выражении (19) величиной 


У малорастворимого газа различие в концентрациях у поверхности и в основном потоке невелико, следовательно, можно принять, что у 


При малой растворимости газа, как это следует из (22), скорость абсорбции определяется скоростью массоотдачи в жидкой фазе. Для хорошо растворимых газов величина m мала. Поэтому в выражении (19) можно пренебречь величиной m/ 



В данном случае на скорость абсорбции преимущественно влияет скорость диффузии в газовой фазе.
Для повышения скорости абсорбции на практике зачастую достаточно интенсифицировать ту или иную стадию. У газов со средними значениями растворимости необходимо учитывать скорость первой и третьей стадии процесса.
Технологический расчет аппарата со ступенчатым контактом фаз.
Дата добавления: 2014-03-24 ; просмотров: 3724 ; Нарушение авторских прав
Особенность процесса – существенная дискретная неоднородность удельной поверхности контакта фаз по высоте аппарата. Кроме того, в большинстве случаев для них не приемлемо допущение о параллельном движении фаз в режиме идеального вытеснения, которое использовалось при выводе основного уравнения массопередачи.
Рассмотрим схему проектного технологического расчёта массообменного аппарата со ступенчатым контактом фаз на примере тарельчатой колонны с противоточным движением газовой и жидкой фаз (рис.1.10).
Расход жидкой фазы 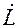

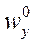
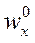
Рис. 1.10. Изменение концентраций фаз по высоте тарельчатой колонны (а) и схема тарельки (б)
Высоту колонны можно связать с числом тарелок N и межтарельчатым расстоянием 

Величина 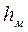
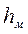
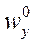
Основная задача – определение N, обеспечивающих необходимый перенос распределяемого компонента из одной фазы в другую. Для этого вводится понятие эффективности тарелки по Мэрфри (кпд тарелки) 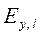

где 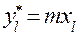

Если 
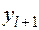

Следует отметить, что при этом составы фаз рассматриваются в различных сечениях аппарата (


Рассмотрим различные способы определения число тарелок N.
Потарелочный расчёт колонны.
Это аналитический метод определения N основан на решение уравнений материального баланса, равновесия и использования эффективности по Мэрфи для каждой тарелки.
Для нижней тарелки под номером 1составы фаз известны 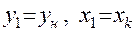
Рассмотрим вторую тарелку. Запишем необходимые уравнения:
уравнение равновесия 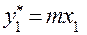
уравнение Мэрфри 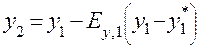
уравнение рабочей линии 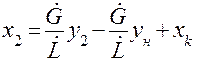
Итак нашли составы фаз для тарелки 2. Далее, также для 3 тарелки и т.д.
Для тарелки 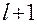
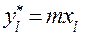
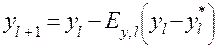

Расчёт заканчивается при значении l, для которого начинает выполняться условие 
Для ориентировочных расчётов, выполняемых вручную, используют упрощенные графические способы нахождения числа тарелок.
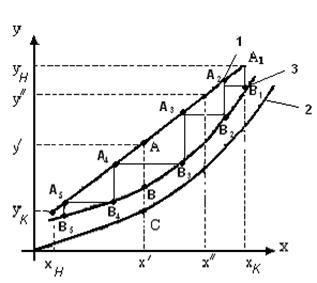
Определение числа тарелок с помощью кинетической кривой.
Эффективность по Мэрфри рассчитывается не для каждой тарелки, а лишь для нескольких сечений колонны, аналитическое решение уравнений (1.64-1.69) заменяется графическим.
Алгоритм действий следующий:
— строятся рабочая и равновесная линии;
— для нескольких сечений аппарата (нескольких рабочих концентраций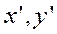
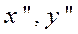

—находят величины.

— на диаграмме х – у наносятся точки 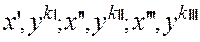
— из точки 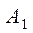
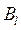


Таким образом, аналитическое решение заменяется графическим определением число ступеней лестницы.
Рис.1.11. Определение числа тарелок с помощью кинетической кривой:
1 – рабочая линия, 2 – равновесная линия, 3 – кинетическая кривая.
Определение числа тарелок с помощью кпд колонны
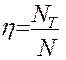
где 


Алгоритм действий следующий:
— аналитическим или графическим способом определяется 
— по известным эмпирическим формулам рассчитывается к.п.д. колонны 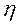
— по формуле (1.71) находят необходимое 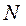
2. АБСОРБЦИЯ.
Абсорбцией называется процесс избирательного поглощения газов или паров из газовых или парогазовых смесей жидким поглотителем – абсорбентом. Если поглощаемый газ – абсорбтив – химически не взаимодействует с абсорбентом, то такая абсорбция физическая,
если же абсорбтив образует с абсорбентом химическое соединение, то такой процесс называется хемосорбцией.
Физическая абсорбция обратима, выделение поглощаемого газа из раствора – десорбция. Сочетание абсорбции и десорбции позволяют многократно использовать поглотитель и выделять поглощённый газ в чистом виде. Инертный газ – компонент газовой смеси не переходящий границу раздела фаз.
Абсорбция применяется:
— для получения готового продукта (абсорбция 
— для выделения ценных компонентов из газовых смесей (абсорбция бензола из коксового газа, абсорбция ацетилена из газов крекинга или пиролиза природного газа и т.д.), при этом абсорбцию проводят в сочетании с десорбцией;
— для очистки газовых выбросов от вредных примесей;
— для осушки газов.
2.1. Равновесие при абсорбции. Закон Генри.
Система состоит из трёх компонентов (распределяемое вещество А и два распределяющих вещества) и двух фаз – жидкой и газовой. Такая система по правилу фаз имеет три степени свободы: 




где 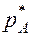

Растворимость газа в жидкости при данной температуре пропорционально его парциальному давлению над жидкостью:
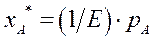
Здесь 
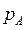
Рис.2.1 Растворимость газа в жидкость от Т.
Для идеальных растворов на диаграмме р–х (рис.2.1) зависимость равновесных концентраций от давления изображается прямой, с наклоном, равным Е.
Как видно из рис.2.1,чем больше Т, тем меньше растворимость.
Если 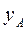
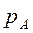
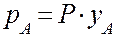
Тогда, с учетом уравнения (2.1) получим:
Итак для закона Генри имеем:
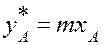
Здесь 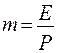
Величина m уменьшается с увеличением Р и снижения Т.
Таким образом, растворимость газа в жидкости растёт с ростом давления и снижения Т.
Когда в равновесии с жидкостью находятся смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Закон Генри справедлив только для идеальных газов, а также к сильно разбавленным реальным растворам.
Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем по закону Генри.
Для систем, не подчиняющихся закону Генри, m является величиной переменной и линия равновесия представляет собой кривую, которую строят обычно по опытным данным.
При больших давлениях (1 МПа и выше) изменение объёма жидкости вследствие растворения в ней газа соизмеримо с изменением объёма газа и равновесие в этом случае не следует закону Генри. При этих условиях константу фазового равновесия можно определить как:
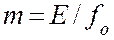

При записи уравнений материального баланса и рабочих линий целесообразно выбрать единицы измерения расходов таковыми, чтобы эти величины не менялись по высоте аппарата. Это сделает рабочие линии прямыми.
При выражении состава фаз не в абсолютных, а в относительных концентрациях видоизменяется и запись закона Генри.
Общая масса фазы, состоящей из распределяемого компонента и 1 кг носителя равна (1+Х) кг (жидкая фаза) и (1+У) кг (газовая фаза). Тогда весовые концентрации х и у распределяемого компонента в фазах:
Тогда закон Генри запишется:

Следовательно, линия равновесия в системе газ – жидкость в координатах Х и У изображается кривой. При малых концентрациях Х в жидкости (2.6) упрощается и принимает вид:
В случае абсорбции многокомпонентных смесей парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но и от концентрации в растворе других компонентов, т.е. является функцией большого числа переменных. Поэтому в подобных случаях, равновесные зависимости основываются на опытных данных.
2.2. Материальный баланс и расход абсорбента
Сначала рассмотрим противоточную абсорбцию. Материальный баланс запишем в виде:
Рис.2.2 Противоточная абсорбция.

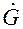
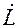
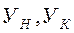

Из уравнения (2.7) обычно определяют 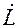
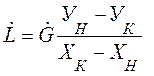
Уравнение (2.7) можно представить в виде:
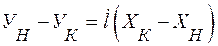
где 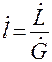
Уравнение (2.9) носит название рабочей линии. Она, рабочая линия, в координатах У-Х прямая с углом наклона, тангенс которого равен 

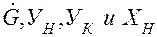
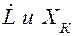
Рис.2.3. Определение удельного расхода абсорбера 
Поскольку 



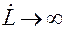
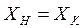
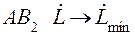

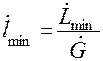

Для предварительных расчетов, можно принять 

Уравнения материального баланса для прямотока аналогичны уравнениям материального баланса противотока (2.7) – (2.9). Однако 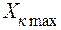
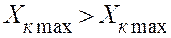
Согласно уравнению (2.10) получим:
Удельный расход абсорбента 
Эффективность работы массообменного аппарата может быть охарактеризована степенью извлечения распределяемого компонента из отдающей его фазы.
Коэффициент извлечения 

Для одинаковых 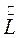
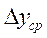

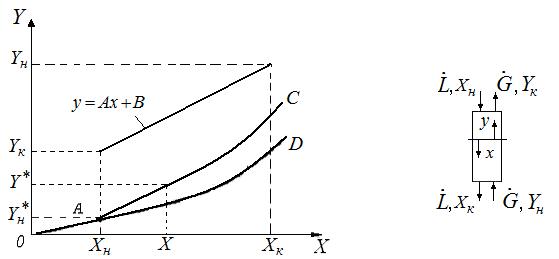
2.3 Тепловой баланс абсорбции.
Рис.2.5. Кривые равновесия при изотермической (OAD) и неизотермической абсорбции (ОАС).
При изотермической абсорбции линия равновесия характеризуется кривой OАD (рис.2.5).
В случае неизотермической абсорбции при растворении газа в жидкости температура её повышается вследствиевыделения теплоты. Тогда линия равновесия характеризуется кривой ОАС.
Для технических расчётов нагреванием газа пренебрегают, считают, что вся теплота идёт на нагрев жидкости.
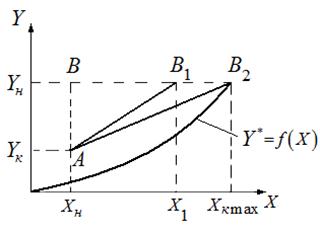
Если известна Т°К при данном составе, то можно найти по справочникам У* на кривой равновесия, соответствующую составу Х. Для этого нужно составить уравнение теплового баланса для части абсорбера, расположенной выше некоторого сечения с текущими концентрациями Х и У соответственно, т.е. в той части аппарата, где произошло поглощение газа:

Здесь 
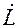

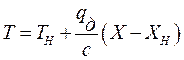
С помощью (2.13), задаваясь значениями Х в пределах 


Как видно из рис.2.5 для случая неизотермической абсорбции произошло уменьшение движущей силы процесса. Чтобы этого избежать необходимо предусмотреть отвод тепла из аппарата.
2.4 Кинетика абсорбции.
Физическая абсорбция. Применительно к абсорбции уравнение массопередачи, если движущую силу выражают в концентрациях газовой фазы, принимает вид:

Если движущую силу выразить в концентрациях жидкой фазы, то уравнение массопередачи имеет вид:

Коэффициенты массопередачи определяются:


В хорошо растворимых газах m незначительно, а 
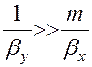

Для плохо растворимых газов можно пренебречь диффузионным сопротивлением в газовой фазе, так как 

Для процесса абсорбции в уравнение массопередачи (2.14) молярные концентрации газовой фазы может быть заменены парциальными давлениями газа, выраженными в долях общего давления:

Здесь 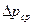
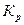
Если равновесная линия прямая, то для 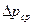


Здесь 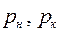
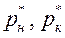
Если парциальное давление выражено в долях общего давления Р, то коэффициенты массопередачи 

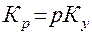
Хемосорбция. Если химическая реакция идет в жидкой фазе, то часть газообразного компонента переходит в связанное состояние. При этом концентрация свободного компонента в жидкости снижается и увеличивается движущая сила процесса.
В общем случае скорость хемосорбции зависит как от скорости химической реакции, так и от скорости массопередачи между фазами. В зависимости от того, какая скорость определяет общую скорость переноса массы, различают кинетическую и диффузионную области процессов хемосорбции.
В кинетической области скорость собственно химического взаимодействия меньше скорости массопереноса и поэтому лимитирует скорость всего процесса. В диффузионной области лимитирующей стадией является скорость диффузии компонентов в зоне реакции, которая зависит от гидродинамических условий в системе и определяется по основному уравнению массопередачи.
Если скорости химической реакции и массопередачи соизмеримы, то такие процессы абсорбции протекают в смешанной, или диффузионно-кинетической области.
Коэффициент массоотдачи в жидкой фазе 

где Ф – фактор ускорения массообмена, 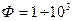
2.5 Конструкции абсорберов.
Абсорбция протекает на поверхности раздела фаз. Поэтому абсорберы должны обеспечить развитую поверхность контакта фаз. По способу образования поверхности раздела фаз абсорберов можно разделить на 4 группы:
Плёночные абсорберы.
В данных аппаратах поверхностью контакта фаз является поверхность жидкой пленки, стекающий по вертикальной твердой стенке и контактирующей с газовым потоком. Различают следующей аппараты этого вида: трубчатые, с плоскопараллельной насадкой и с восходящим движением пленки.
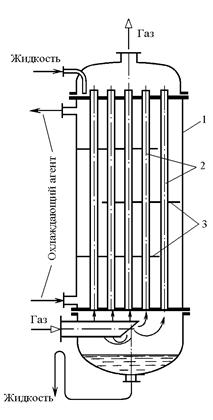
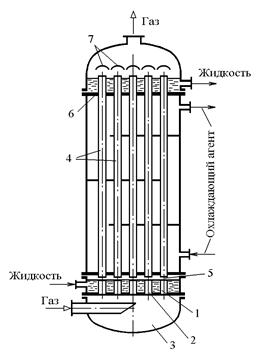
Трубчатые абсорберы (рис.2.6) аналогичны на конструкции с вертикальными кожухотрубчатыми теплообменниками. Жидкий абсорбент поступает на верхнюю трубную решетку и в виде пленки стекает по внутренней поверхности труб вниз, а навстречу ему движется газовый поток по трубам со скоростью 3 – 6 м/с. Если при абсорбции выделяется тепло, то в межтрубное пространство подается охлаждающий агент.
Рис.2.6. Трубчатый пленочный абсорбер: 1 – корпус; 2 – трубка; 3 – перегородки.
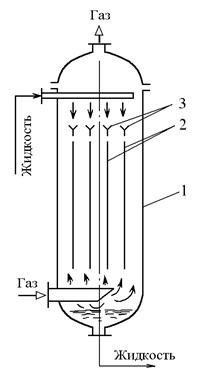
Рис.2.7. Пленочный абсорбер с плоскопараллельной (листовой) насадкой: 1 – колонна, 2 – пакеты листовой насадки, 3 – распределительное устройство.
Аппараты с плоскопараллельной насадкой (рис.2.7) представляет собой вертикальную колонну 1, внутри которой расположены вертикально и параллельно друг к другу плоские прямоугольные листы насадки 2, изготовленные из металла, пластмасс и т.д. Жидкий абсорбент течет сверху вниз, а газ снизу вверх.
Аппараты с восходящим движением пленки жидкости (рис.2.8) схожи с трубчатыми абсорберами, однако работают в режиме восходящего прямотока, Газ двигаясь большой скоростью (более 10 м/с) увлекает жидки абсорбент по трубам в виде пленки. Преимущества этих аппаратов по сравнению с противоточными трубчатыми являются большие производительности и коэффициенты массопередачи, а недостатками – большие гидравлические сопротивления, сложность конструкции, меньшие коэффициенты извлечения.
Рис. 2.8. Пленочный абсорбер с восходящем движением жидкости:
http://megaobuchalka.ru/12/32188.html
http://life-prog.ru/1_27499_tehnologicheskiy-raschet-apparata-so-stupenchatim-kontaktom-faz.html