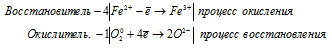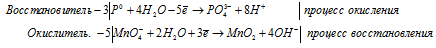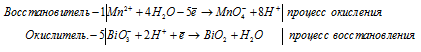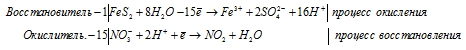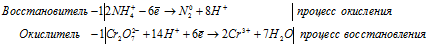NH3 * H2O + HNO3 = Что получается и краткое ионное?
Химия | 10 — 11 классы
NH3 * H2O + HNO3 = Что получается и краткое ионное.
NH3∙H2O + HNO3 (разб.
Полное ионное ур — е :
NH3∙H2O + H + + NO3− → NH4 + + NO3− + H2O
Краткое ионное ур — е :
NH3∙H2O + H + → NH4 + + H2O.
Полное и краткое ионное Na2O + CO2?
Полное и краткое ионное Na2O + CO2.
Как решить молекулярное , краткое ионное и полное ионное уравнения в химии?
Как решить молекулярное , краткое ионное и полное ионное уравнения в химии.
Осуществите превращения :HNO₃⇒Cu(NO₃)₂⇒NO₂⇒HNO₃?
Напишите уравнения реакций между веществами :а) HNO₃ + NH₄HCO₃ ⇒б) HNO₃ + Cu(OH)₂⇒в) HNO₃ + MgO⇒г) BaCO₃ + HNO₃⇒д) HNO₃ + NaOH⇒е) HNO₃ + Al₂O₃⇒ж) HNO₃(разб?
Напишите уравнения реакций между веществами :
Здравствуйте, напишите, пожалуйста, молекулярное и ионное уравнения : азотная кислота(HNO) + карбонат кальция (Ca)?
Здравствуйте, напишите, пожалуйста, молекулярное и ионное уравнения : азотная кислота(HNO) + карбонат кальция (Ca).
В 1 нужно записать молекулярно ионное и краткое ионное уравнение?
В 1 нужно записать молекулярно ионное и краткое ионное уравнение.
Закончите молекулярные уравнения возможных химических реакций и запишите соответствующие им ионные уравнения :а)ZnO + HNO₃б)Al + H₂SO₄(Разб)в)HNO₃ + CuSO₄г)HCL + FeSд)H₂SO₄ + Fe(OH)₃?
Закончите молекулярные уравнения возможных химических реакций и запишите соответствующие им ионные уравнения :
Решить ионное уравнениеMgO + HNO³ = > Mg (NO³) + H²O?
Решить ионное уравнение
MgO + HNO³ = > Mg (NO³) + H²O.
HCl + Feзакончить, составить подное ионное и краткое ионное?
закончить, составить подное ионное и краткое ионное.
CuSo4 + Na2Sкраткое ионное уравнение?
краткое ионное уравнение.
Вы находитесь на странице вопроса NH3 * H2O + HNO3 = Что получается и краткое ионное? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
2С4Н10 + 13О2 = 8СО2 + 10Н2О по закону Авогадро V CO2 / VC4H10 = 8 / 2 = 1 / 4 V CО2 = 4 * 5 = 20 л.
Заранее извиняюсь за качество фото.
1)расставляем коэффициенты 2)указываем С. О. каждогоэлемента 3)составляем ионное уравнение 4)сокращаем одинаковое 5)составляем сокращенное ионное уравнение.
3FeCl2 + 2Al — > 2AlCl3 + 3Fe Fe( + 2) + 2e — > Fe(0) 3 в — ие ок — ль Al(0) — 3e — > Al( + 3) 2 ок — ие в — ль 3Fe( + 2) + 6Cl( — ) + 2Al(0) — > 2Al( + 3) + 6Cl( — ) + 3Fe(0) 3Fe( + 2) + 2Al(0) — > 2Al( + 3) + 3Fe(0).
А) N2O5 б) Mg3N2 в) SO3 г) Na2S д) AsF3.
M(Na2CrO4) = 23 * 2 + 52 + 16 * 4 = 46 + 64 + 52 = 162 г / моль M((NH4)2SO4) = 14 * 2 + 1 * 8 + 32 + 16 * 4 = 28 + 8 + 32 + 64 = 132 г / моль M(Fe2(SO4)3) = 56 * 2 + 32 * 3 + 16 * 12 = 112 + 96 + 192 = 400 г / моль.
0. 15G / (G + M) = 0. 05 G — масса 15% раствора. M — масса воды M = 2G для получения 5% раствора нужно взять воды по массе в два раза более массы раствора. Учтём что плотность раствора и воды примерно одинаковы и получим что нужно взять один объём..
Химические свойства кислот 1) Диссоциация : HCl + nH2OH + ×kH2O + Cl–×mH2O (сокращенно : HCl H + + Cl– ). Многоосновные кислоты диссоциируют по ступеням (в основном по первой) : H2SO4 H + + НSO4– (1 ступень) и HSO4– H + + SO42– (2 ступень). 2) Взаи..
Массу. Агрегатное состояние характерно для вещества.
ПРАВИЛЬНЫЙ ОТВЕТ ПЕРВЫЙ АГРЕГАТНОЕ СОСТОЯНИЕ.
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655
http://chemege.ru/azotnaya-kislota/