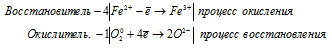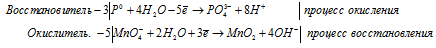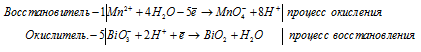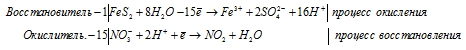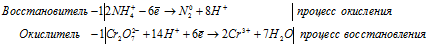Nh3 h2o h3po4 уравнение реакции
1) Является сильным восстановителем, потому что азот в нём имеет минимальную степень окисления -3.
Восстановительные свойства проявляет по отношению (запишите уравнения реакций и рассмотрите с позиций окисления-восстановления):
| а) 4NH3 + 5O2 кат. ⟶ 4NO + 6H2O | ||||
| N -3 — 5ē ⟶ N +2 | 5 | 20 | 4 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 5 | окислитель (восстановление) | |
| б) 4NH3 + 3O2 ⟶ 2N2 + 6H2O | ||||
| 2N -3 — 6ē ⟶ N2 0 | 6 | 12 | 2 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 3 | окислитель (восстановление) | |
– к оксидам металлов:
| 2NH3 + 3CuO ⟶ 3Cu + N2 + 3H2O | ||||
| 2N -3 — 6ē ⟶ N2 0 | 6 | 6 | 1 | восстановитель (окисление) |
| Cu +2 + 2ē ⟶ Cu 0 | 2 | 3 | окислитель (восстановление) | |
2) Взаимодействует с водой, образуя непрочное основание – гидрат аммиака NH3∙H2O, который, как слабый электролит, незначительно диссоциирует:
NH3∙H2O ⇄ NH4 + + OH — .
10%-й раствор аммиака в воде – это нашатырный спирт.
Образование иона аммония отражает схема:
| H3N: | + | ☐H + | ⟶ | NH4 + |
| донор | акцептор |
Различают два механизма образования ковалентной связи:
1) Обменный;
2) Донорно-акцепторный.
Составьте молекулярные уравнения реакций по схеме N2 → NH3 → NH3 • Н20 → (NH4)2S04. Уравнение 1 рассмотрите с точки зрения теории ОВР, уравнение 3 запишите в ионном виде
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
http://www.soloby.ru/471139/%D1%81%D0%BE%D1%81%D1%82%D0%B0%D0%B2%D1%8C%D1%82%D0%B5-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%80%D0%B0%D1%81%D1%81%D0%BC%D0%BE%D1%82%D1%80%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655