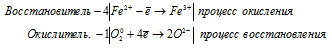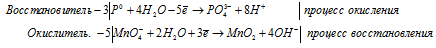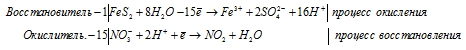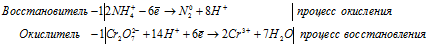Nh3 h2so4 ионное уравнение полное и сокращенное
Вопрос по химии:
13.18 напишите уравнение реакций между следующими веществами в молекулярной,ионной и сокращенной ионных формах:
а)NH3+H2SO4->.
б)NH3+P2O5->.
в)NH4NO3+KOH->.
г)NH4Cl+Pb(NO3)2->.
д)(NH4)2SO4+Ca(OH)2->.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
А)2NH3+H2SO4 => (NH4)2SO4
Полная ионная форма:
2H(+) + SO4(2-) + 2NH3 =>2NH4+ + SO4(2-)
Краткая ионная форма:
2H(+) + 2NH3 => 2NH4(+ ) в)NH4NO3+ KOH —> KNO3 + H2O + NH3 молекулярное
NH4+ +NO3- + K+ +OH- —> K+ +NO3- + H2O + NH3 полное ионное
NH4+ +OH- —> H2O + NH3 сокращенное ионное г)NH4Cl+Pb(NO3) ——> Pb(Cl2+ NH4(NO3 NH4+ +Cl- +Pb2+ +NO3-=Pb2+ +2Cl- +NH4+ +NO3-(полная) NH4+ +NO3- =NH4(NO3) (краткая) д) (NH4)2SO4+Ca(OH)2 = CaSO4+2NH3+2H2O 2NH4+SO4+Ca + 2OH = Ca +SO4+2NH3+2H2O (полная) 2NH4+2OH=2NH3+2H2O (краткая)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
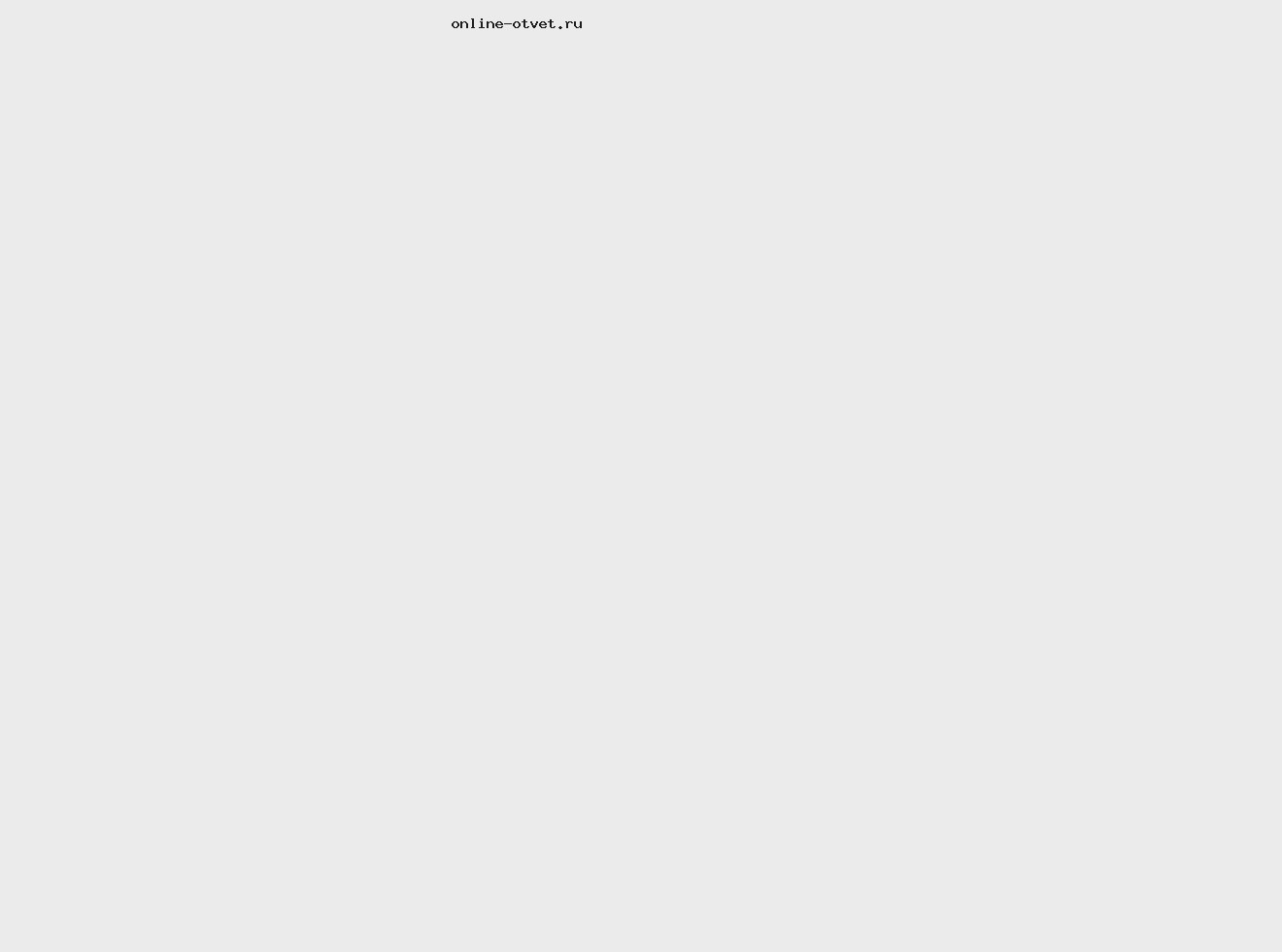
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
Nh3 h2so4 ионное уравнение полное и сокращенное

Посмотрим, как аммиак NH 3 взаимодействует с концентрированными кислотами – соляной HCl , азотной HNO 3 и серной H 2 SO 4 . Приготовим стаканы с концентрированным раствором аммиака. При добавлении соляной кислоты к раствору аммиака появляется белый дым — выделяется соль — хлорид аммония.
Добавление азотной кислоты в стакан с аммиаком приводит к появлению белого нитрата аммония.
При добавлении серной кислоты появляются белые кристаллы сульфата аммония.
Аммиак взаимодействует со всеми растворимыми в воде кислотами с образованием солей аммония
Оборудование: химические стаканы.
Техника безопасности . Опыт следует проводить под тягой. Соблюдать правила работы с концентрированными кислотами и щелочами.
Постановка опыта – Елена Махиненко , текст – к.п.н. Павел Беспалов.
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655
http://school-collection.edu.ru/dlrstore-wrapper/37ed4656-d373-180a-8e85-3707ff3cab0e/index.htm