Гидролиз нитрата аммония
NH4NO3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Полное ионное уравнение
NH4 + + NO3 — + HOH ⇄ NH4OH + H + + NO3 —
Сокращенное (краткое) ионное уравнение
NH4 + + HOH ⇄ NH4OH + H +
Среда и pH раствора нитрата аммония
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
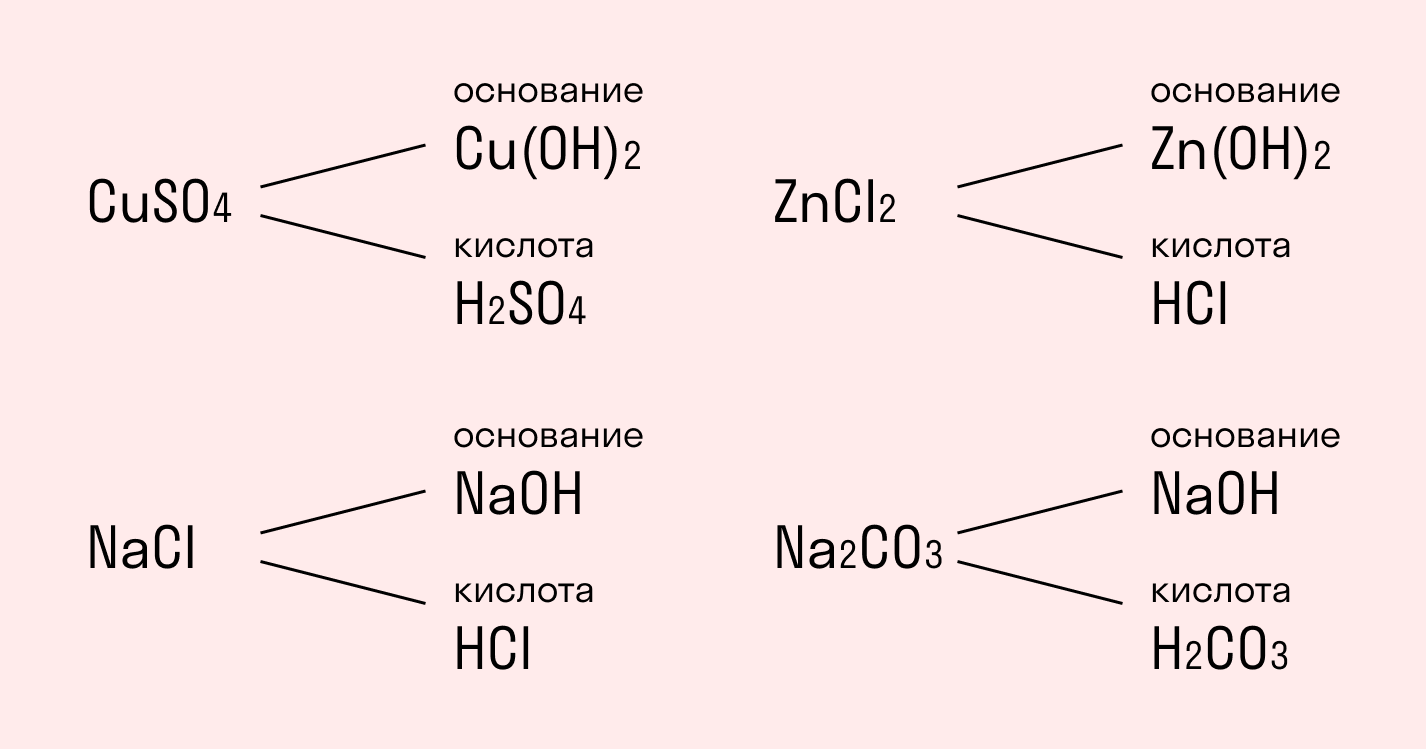
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
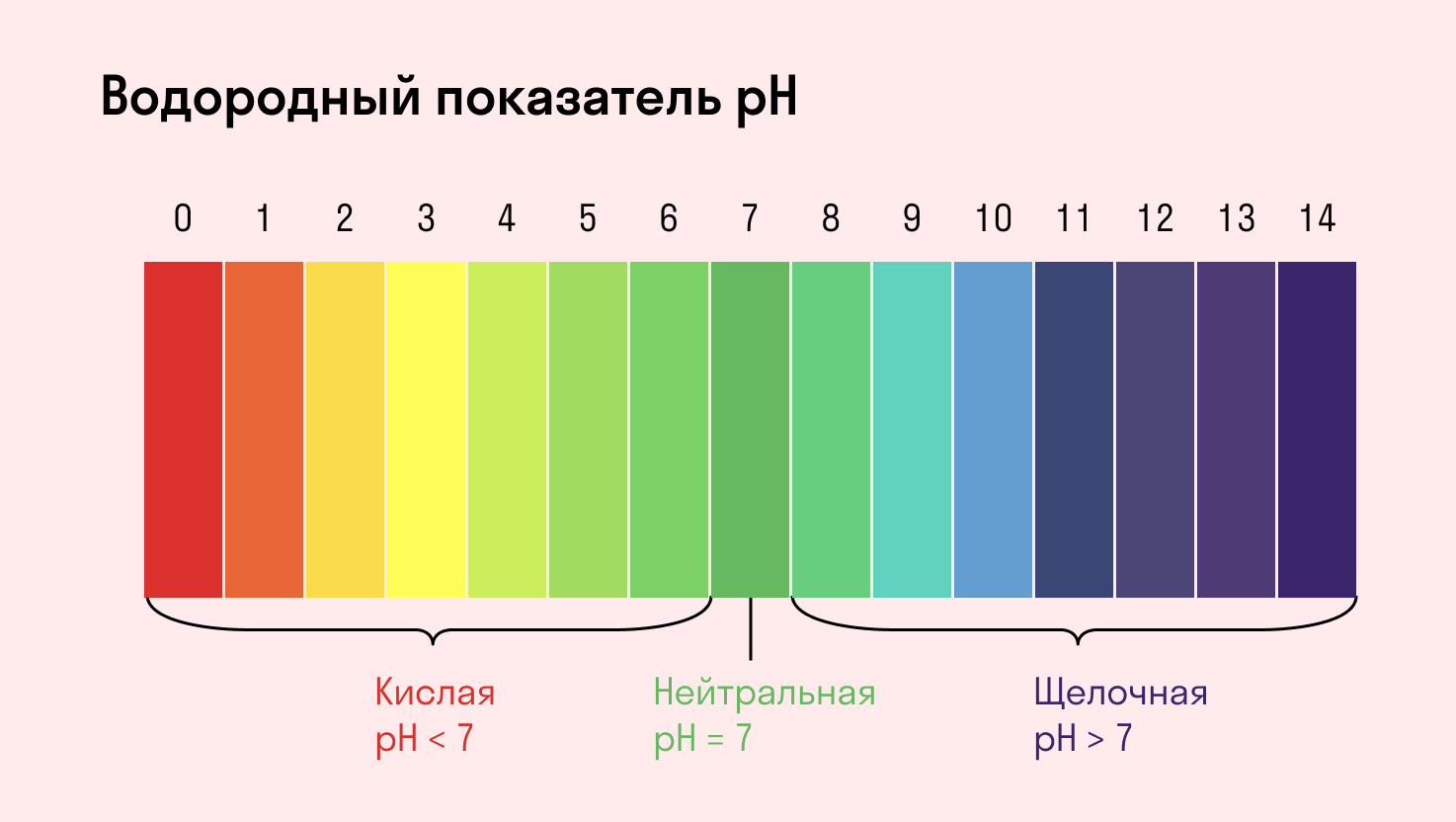
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
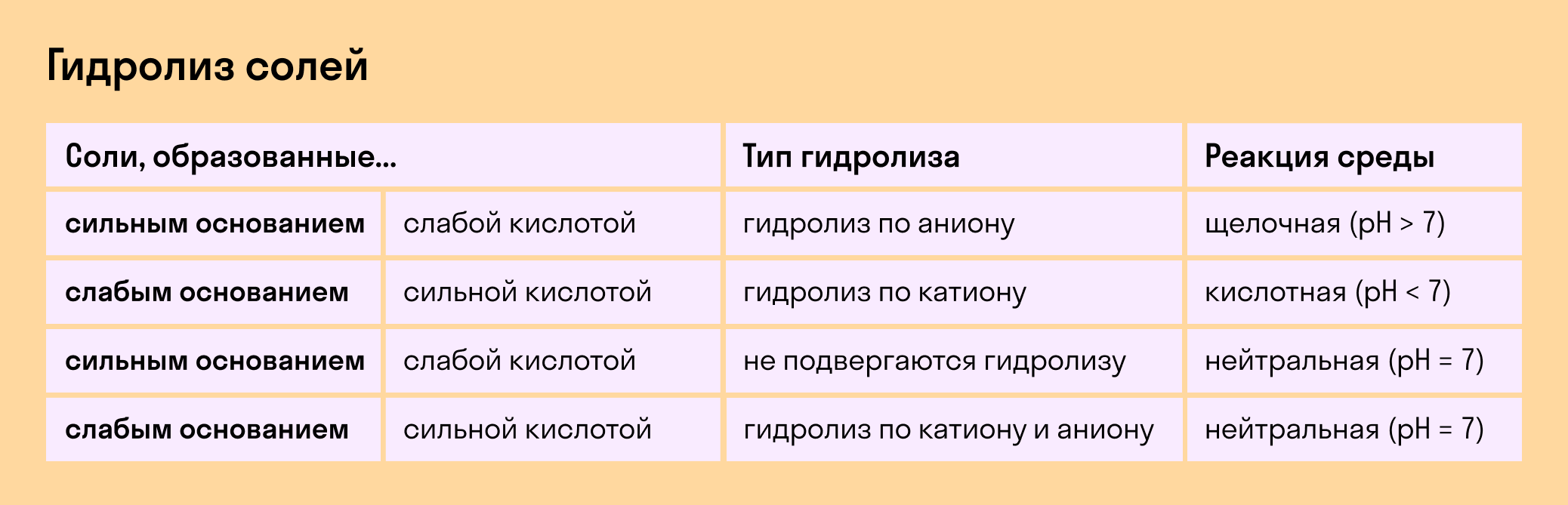
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
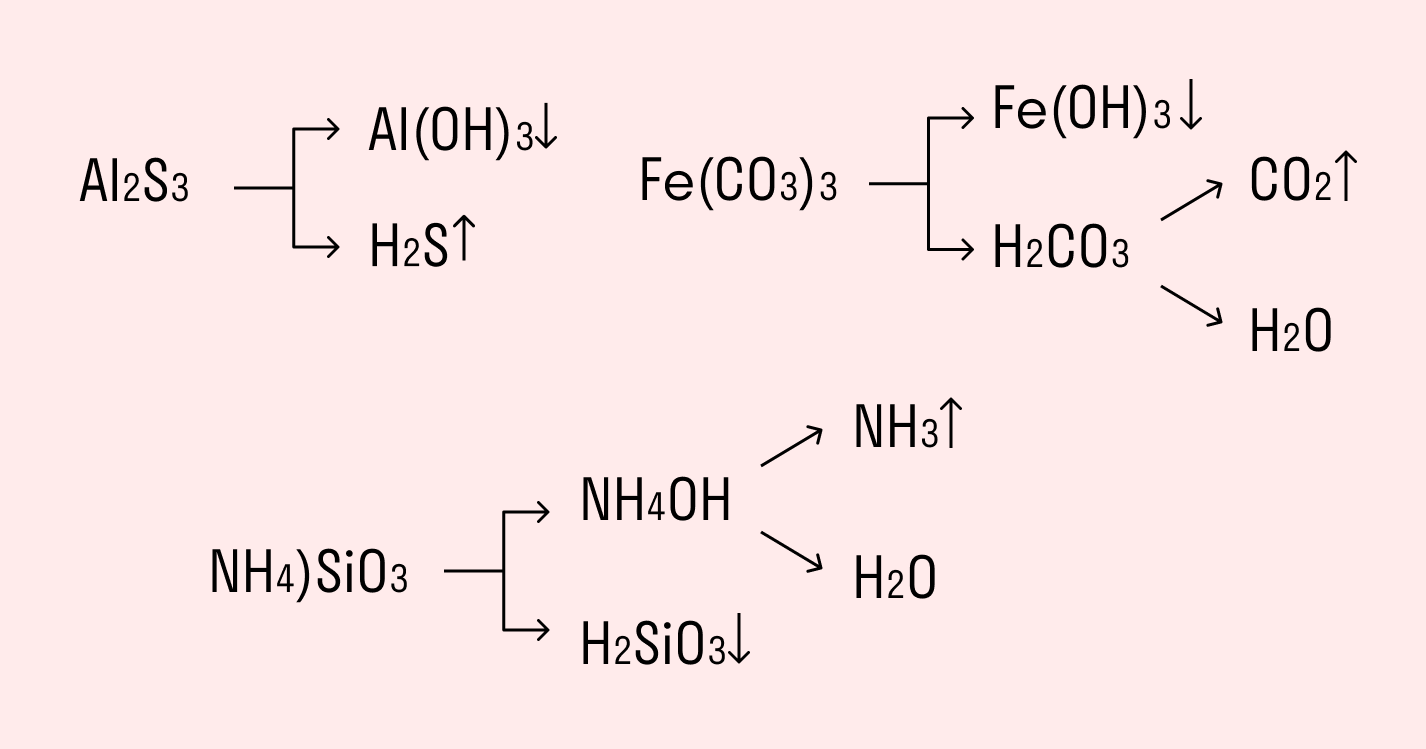
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Азот. Аммиак. Соли аммония
Селитра – природные нитраты натрия и калия – была известна в Китае в первые века нашей эры; ее использовали для приготовления пороха и проведения фейерверков. Позже она упоминается в трудах европейских алхимиков (латинские названия – nitro или sal nitri). Нагревая селитру с железным купоросом, алхимики получали азотную кислоту, которая длительное время называлась по-латыни aqua fortis («крепкая вода»; в русских текстах обычно встречается термин «крепкая водка»).
Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой):

Он же обнаружил, что при взаимодействии азотной кислоты с поташом K2CO3 образуется чистая калийная селитра. Это открытие имело большое практическое значение, ведь раньше селитру, необходимую для производства пороха, ввозили в Европу из стран Востока, а также выделяли из соляного налёта на стенах конюшен или из селитряных ям, где она образовывалась под действием микроорганизмов как конечный продукт окисления азотсодержащих органических соединений.
При прокаливании смеси селитры NaNO3,железного купороса FeSO4∙7H2O, алюмокалиевых квасцов KAl(SO4)2∙12H2O и нашатыря NH4Cl алхимикам удалось получить жидкость, растворявшую даже «царя металлов» — золото. Поэтому ее и назвали aqua regia, что значит «царская вода» или «царская водка». Царская водка – жидкость жёлтого цвета, образующаяся при смешении трёх объёмов соляной и одного объёма азотной кислот. В царской водке без труда растворяется даже платина.
Азот независимо друг от друга открыли в конце XVIII в. несколько учёных. Английский исследователь Генри Кавендиш получил «мефитический воздух» (так он назвал азот), многократно пропуская воздух над раскаленным углем (тем самым удаляя кислород), а потом через раствор щелочи для поглощения образовавшегося углекислого газа СО2.

Соотечественник Кавендиша Джозеф Пристли описал образование газа, не поддерживающего горение и дыхание, — «флогистированного воздуха», — наблюдая за горением свечи в закрытом сосуде.
Наконец, ещё один английский учёный, Даниэль Резерфорд, также получил азот из воздуха. В отличие от Кавендиша и Пристли, он сразу же, 1772 г., опубликовал работу, где описал получение и свойства выделенного им «удушливого воздуха». Поэтому именно Резерфорд считается первооткрывателем азота.
В природе наибольшее количество азота находится в несвязанном виде в воздухе. Основной состав атмосферного воздуха определил А.Л.Лавуазье, по предложению которого новый элемент и назвали азотом. Название это составлено из греческого слова «зое» («жизнь») и приставки «а»- («не-») и означает «безжизненный», «не дающий жизнь». Латинское низвание азота – Nitrogenium – переводится как «образующий селитру».
Редко встречаются минералы, которые содержат азот, например чилийская селитра NaNO3, залежи которой тянутся вдоль побережья Чили и Перу на расстояние свыше 3600 км. В конце XIX в. добыча ее составляла примерно 0,5 тонн в год. Не случайно у предпринимателей и ученых возникали опасения в том, что скоро ее запасы иссякнут. Это и подтолкнуло химиков к разработке технологий по связыванию азота воздуха.
В промышленности азот получают из жидкого воздуха. Для этого воздух переводят в жидкое состояние, и при температуре – 196 0 С азот испаряется.
В лаборатории азот получают разложением нитрита аммония NH4NO2 при нагревании:
Физические свойства
Азот – газ без цвета, вкуса и запаха (tпл = -210 0 С, tкип = -196 0 С), мало растворимый в воде. Свободный азот химически инертен из-за высокой прочности молекулы N2, в которой атомы связаны тройной связью. Поэтому азот с трудом вступает в химические реакции, не поддерживает горение и дыхание.
Характерные степени окисления:
— 3 0 +1 +2 +3 +4 +5
Химические свойства
В химических реакциях азот может быть как окислителем, так и восстановителем.
Азот взаимодействует как окислитель:
Азот взаимодействует как восстановитель:
Применение
Азот является исходным сырьем для получения аммиака, азотной кислоты и азотных удобрений.
Аммиак
Аммиак – бесцветный газ с резким запахом, хорошо растворимый в воде. В одном литре воды при температуре 20 0 С растворяется 700 л аммиака. Этот раствор называется аммиачной водой или нашатырным спиртом.
Химические свойства
Кислотно-основные свойства
Атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи. В частности, атом азота в NH3 способен присоединять ион водорода Н + . Вещества, молекулы которых способны присоединять ионы водорода, обладают основными свойствами. Следовательно, аммиак обладает основными свойствами:
- взаимодействие аммиака с водой:
- взаимодействие с галогеноводородами:
- взаимодействие с кислотами (в результате образуются средние и кислые соли):
- аммиак взаимодействует с солями некоторых металлов с образованием комплексных соединений – аммиакатов:
AgCl + 2NH3 = [Ag(NH3)2]Cl Хлорид диамин серебра (I)
Окислительно – восстановительные свойства
В молекуле аммиака азот имеет степень окисления – 3, поэтому в окислительно – восстановительных реакциях он может только отдавать электроны и является только восстановителем.
- аммиак восстанавливает некоторые металлы из их оксидов:
- аммиак окисляется кислородом без катализатора до азота:
- аммиак в присутствии катализатора окисляется до монооксида азота NO:
Соли аммония
При взаимодействии аммиака или гидроксида аммония с кислотами образуются соли аммония:
Все соли аммония хорошо растворимы в воде. Соли аммония имеют общие свойства солей. К особым свойствам солей аммония относятся реакции их термического разложения, которые протекают по-разному, в зависимости от характера аниона, например:
Реакция взаимодействия солей аммония со щелочью является качественной реакцией на катион аммония NH4 + :
Выделяющийся аммиак определяют по запаху или по посинению влажной лакмусовой бумаги.
Применение аммиака и солей аммония
Из аммиака получают азотную кислоту, гидроксид аммония (нашатырный спирт), соли аммония и т.д. Нашатырный спирт NH4OH и нашатырь NH4Cl широко применяется в медицине. Нитрат аммония, фосфат аммония и другие аммонийные соли используются в сельском хозяйстве в качестве удобрений.
Скачать:
Скачать бесплатно реферат на тему: «Азот» Azot.doc (267 Загрузок)
Скачать бесплатно реферат на тему: «Азот и фосфор» Азот-и-фосфор.docx (265 Загрузок)
Скачать бесплатно реферат на тему: «Соединения азота» Соединения-азота.docx (233 Загрузки)
Скачать бесплатно реферат на тему: «Производство азотных удобрений» ПРОИЗВОДСТВО-АЗОТНЫХ-УДОБРЕНИЙ.docx (235 Загрузок)
Скачать бесплатно реферат на тему: «Аммиак» Аммиак.docx (275 Загрузок)
Скачать бесплатно реферат на тему: «Аммиачная селитра» Аммиачная-селитра.docx (249 Загрузок)
Скачать рефераты по другим темам можно здесь
http://skysmart.ru/articles/chemistry/gidroliz
http://al-himik.ru/azot-ammiak-soli-ammonija/