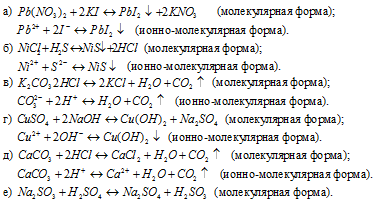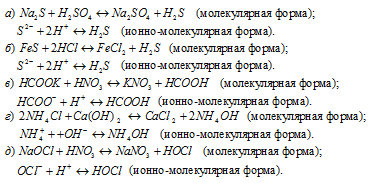Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0e0bfaceb0977f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
FeCl3 + (NH4)2S = Написать молекулярное и ионное уравнение взаимодействие?
Химия | 10 — 11 классы
FeCl3 + (NH4)2S = Написать молекулярное и ионное уравнение взаимодействие.
2FeCl3 + 3(NH4)2S + 6H2O = 6NH4Cl + 2Fe(OH)3 + 3H2S
Напишите молекулярное, полное и сокёкрашенное ионное уравнения реакции взаимодействия?
Напишите молекулярное, полное и сокёкрашенное ионное уравнения реакции взаимодействия.
Написать уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, полном и сокращенном ионном виде?
Написать уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, полном и сокращенном ионном виде.
Написать в молекулярной и ионной формах уравнения возможных реакций взаимодействия соединений с NaOH и H2SO4 и KOH?
Написать в молекулярной и ионной формах уравнения возможных реакций взаимодействия соединений с NaOH и H2SO4 и KOH.
Составить молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между (NH4)2SO4 и BaCl2?
Составить молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между (NH4)2SO4 и BaCl2.
Составить молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между (NH4)2SO4 и BaCl2?
Составить молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между (NH4)2SO4 и BaCl2.
Написать молекулярные и ионные уравнения к схеме :Fe — — >FeCl₂ — — >Fe(OH)₂ — — >FeSO₄ — — >Fe(OH)₂ — — >FeO — — >Fe?
Написать молекулярные и ионные уравнения к схеме :
Fe — — >FeCl₂ — — >Fe(OH)₂ — — >FeSO₄ — — >Fe(OH)₂ — — >FeO — — >Fe.
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : а) Li2SiO3 и HCl?
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : а) Li2SiO3 и HCl.
Написать молекулярное и ионное уравнение реакции взаимодействия гидроксида цинка с избытком раствора гидроксида натрия?
Написать молекулярное и ионное уравнение реакции взаимодействия гидроксида цинка с избытком раствора гидроксида натрия.
Написать уравнения (молекулярные и ионные) взаимодействие гидроксида алюминия и гидроксида натрия?
Написать уравнения (молекулярные и ионные) взаимодействие гидроксида алюминия и гидроксида натрия.
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между MgSO4 и KOH?
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между MgSO4 и KOH.
Если вам необходимо получить ответ на вопрос FeCl3 + (NH4)2S = Написать молекулярное и ионное уравнение взаимодействие?, относящийся к уровню подготовки учащихся 10 — 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
AlH3, CS2, PbO2, ZnBr2, CF4, FeO, ClO2, Cu2O, AuCl3.
1) 2 — метилпропан 2) 3 — этилбутан 3) 3 — диметилбутан.
CxHy + (x + y / 4)O₂ = xCO₂ + y / 2H₂O M(CxHy) = M(a)D m(CxHy) = 1, 28 г M(a) = 28, 98 г / моль D = 4, 41 n(CxHy) = m(CxHy) / M(CxHy) = m(CxHy) /
Полимерами являются следующие хим. Реакции : Полимеризация (пример : (C6H5CO2)2 ) Поликонденсация (пример : C6H12)6 ).
2 Al + 6 HCl — > 2AlCl3 + 3H2. Замещение Fe2O3 + 3H2SO4 — > Fe2(SO4)3 + 3 H2O. Обмен Cu + HBr — > реакция не идет 2Li + H2 — > 2LiH. Соединение Hg(NO3)2 + Cu — > Cu(NO3)2 + Hg. Замещение N2 + 3 H2 — > 2NH3. Соединение Ag + FeCl3 — > реакция не и..
3) Si ______________________.
Кухонная соль — это неметалл.
Нет соль не является металом.
CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl CaCO₃ (t°C) = CaO + CO₂↑ CaO + 3C (t°C) = CaC₂ + CO↑ CaC₂ + 2H₂O = Ca(OH)₂ + C₂H₂↑.
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
http://himia.my-dict.ru/q/3882884_fecl3-nh42s-napisat-molekularnoe-i-ionnoe/
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582